
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备 CeO2的一种工艺流程如下:
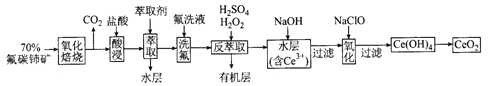
已知:①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_____________。
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:____________;为避免产生上述污染,请提出一种解决方案:_____________。
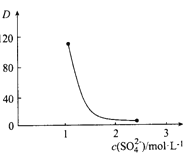
(3)“萃取”时存在反应:Ce4+ +n(HA)2![]() Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____________;下图中D时分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(
Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____________;下图中D时分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(![]() )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________。
(4)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作_________(填“催化剂”“氧化剂”或“还原剂”),每有1molH2O2参加反应,转移电子的物质的量为__________。
(5)“氧化”步骤的化学方程式为_____________。
(6)取上述流程中得到的CeO2产品0.4500 g,加硫酸溶解后,用0.1000mol/LFeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗25.00 mL标准溶液。该产品中CeO2的质量分数为_________。
【答案】(1)增大固体与气体的接触面积,增大反应速率;提高原料的利用率。(2分)
(2)2CeO2+2C1-+8H+=2Ce3++Cl2↑+4H2O;(2分)将HC1(盐酸)改用H2SO4酸浸(1分)
(3)分液漏斗(1分)随着c(SO42-)增大,水层中Ce4+被SO42-结合成[CeSO4]2+,导致萃取平衡向生牛成[CeSO4]2+移动,D迅速减小,(2分)(4)还原剂(1分);2mol(1分);
(5)2C(OH)3+NaClO+H2O=2Ce(OH)4+NaCl(2分)(6)95.56%(2分)
【解析】
试题分析:氟碳铈矿(主要含CeFCO3),“氧化焙烧”的目的是将+3价铈氧化成+4价,Ce4+能与F-结合成[CeFx](4-x)+,以便后续的提取,加稀硫酸,与SO42-结合成[CeSO4]2+,加萃取剂,氟洗液,硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能,加“反萃取”加H2O2,又将Ce4+还原为Ce3+,发生反应2Ce4++H2O2=2Ce3++O2↑+2H+,加入碱后Ce3+转化为沉淀,通入氧气讲Ce从+3氧化为+4,得到产品;
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是增大固体和氧气的接触面积,反应更充分;
(2)“酸浸”中会产生大量黄绿色气体应为氯气,CeO2与盐酸发生氧化还原反应生成Ce3+和氯气,反应的离子方程式为2CeO2 +2C1-+8H+=2Ce3+ +Cl2↑+4H2O,可以用硫酸代替盐酸而避免产生氯气污染;
(3)实验室中萃取时用到的主要玻璃仪器名称为分液漏斗,根据平衡:Ce4+ +n(HA)2![]() Ce·(H2n-4A2n)+4H+,加入Na2SO4时,随着c(SO42-)增大,水层中Ce4+被SO42-结合成[CeSO4]2+,导致萃取平衡向左移动,D迅速减小;
Ce·(H2n-4A2n)+4H+,加入Na2SO4时,随着c(SO42-)增大,水层中Ce4+被SO42-结合成[CeSO4]2+,导致萃取平衡向左移动,D迅速减小;
(4)“反萃取”加H2O2的作用是将Ce4+离子重新还原为Ce3+,反应的离子方程式为2Ce4++H2O2=2Ce3++O2↑+2H+,H2O2在该反应中作还原剂,每有1mol H2O2参加反应,转移电子的物质的量为2mol;
(5)“氧化”步骤中用次氯酸钠将Ce3+氧化成Ce4+,反应的化学方程式为2C(OH)3 + NaClO +H2O=2Ce(OH)4 + NaCl;
(6)FeSO4的物质的量为0.1000molL-1×0.025L=0.0025mol,根据电子得失守恒可得关系式CeO2~FeSO4,所以CeO2的质量为0.0025×172g=0.4300g,产品中CeO2的质量分数为0.4300g/0.4500g×100%=95.60%。


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】某气态烃对空气的相对密度为 2,在氧气中充分燃烧 1.16 g这种烃,并将所得产物通过装有无水氯化钙的干燥管和装有碱石灰的干燥管,当称量这两个干燥管的质量时,它们依次增重 1.8g和 3.52 g。这种烃的化学式是
A.C2H6 B.C4H10 C.C5H10 D.C5H12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
①容量瓶 ②蒸馏烧瓶 ③量筒 ④烧杯 ⑤分液漏斗 ⑥托盘天平
(1)加热时必须垫石棉网的有:_______________,
(2)使用时必须检查是否漏水的有:________________,
(3)标有温度的有:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】aX(g)+bY(g) ![]() cZ(g)+dW(g)在一定容积的密闭容器中反应,5 min时达到平衡,X减少 n mol·L-1,Y减少
cZ(g)+dW(g)在一定容积的密闭容器中反应,5 min时达到平衡,X减少 n mol·L-1,Y减少![]() mol·L-1,Z增加
mol·L-1,Z增加![]() mol·L-1。若将体系压强增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为 ( )
mol·L-1。若将体系压强增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为 ( )
A.3∶1∶2∶1 B.1∶3∶2∶2
C.1∶3∶1∶2 D.3∶1∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 价电子数与最高化合价相等的元素一定是主族元素
B. 次外层全充满而最外层有不成对电子的元素一定是主族元素
C. 所有非金属元素都在p区
D. 元素周期表的5个区中都有金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列条件下,两种气体的分子数一定相等的是( )
①同质量、不同密度的N2和C2H4 ②同温度、同体积的O2和N2
③不同温度压强下、同物质的量的CO2和C2H4 ④同压强、同体积的N2和O2 .
A.①②
B.②③
C.①③
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素的原子序数,可以推断元素原子的( )
①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数
A. ①②③ B. ①④⑤ C. ②③④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存的无色透明离子组是( )
A.Mg2+ Na+ Cl﹣ SO42﹣
B.K+ Na+ CO32﹣ NO3﹣
C.K+ Na+ Cl﹣ Cu2+
D.Na+Ba2+OH﹣ SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上…其清如水,味极浓烈,盖酒露也.”这里所用的“法”是指( )
A.萃取
B.渗析
C.蒸馏
D.干馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com