
【题目】下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7;②用HF溶液做导电性实验,灯泡很暗;③等物质的量浓度的HCl溶液和HF溶液与足量锌粒反应,刚开始HCl溶液产生的气泡快;④常温下0.1mol/L的HF溶液pH为2.3;⑤HF能与Na2CO3溶液反应,产生CO2气体;⑥HF与水能以任意比混溶;⑦1mol/L的HF水溶液能使紫色石蕊试液变红;⑧pH=3的HF溶液稀释至原体积的10倍,pH值减小0.6;⑨等物质的量浓度的HCl溶液和HF溶液与足量锌粒反应,产生氢气的量一样多
A.①③④B.①②③④⑤⑧C.②④⑧⑨D.①②⑦⑧
【答案】A
【解析】
①常温下NaF溶液的pH大于7,说明F-能发生水解,一定能说明HF是弱酸;
②用HF溶液做导电性实验,灯泡很暗,因为没有与相同条件下的强酸进行对比,不能说明HF是弱酸;
③等物质的量浓度的HCl溶液和HF溶液与足量锌粒反应,刚开始HCl溶液产生的气泡快,说明在盐酸中![]() 较大,而HF溶液中
较大,而HF溶液中![]() 较小,故一定能说明HF是弱酸;
较小,故一定能说明HF是弱酸;
④常温下0.1mol/L的HCl的pH为1,而0.1mol/L的HF溶液pH为2.3,说明HF没有完全电离,故一定能说明HF是弱酸;
⑤HF能与Na2CO3溶液反应,产生CO2气体,只能说明其有酸性且酸性强于碳酸,但是不能说明HF是弱酸;
⑥HF与水能以任意比混溶,说明了HF的溶解性好,但不能说明HF是弱酸;
⑦1mol/L的HF水溶液能使紫色石蕊试液变红,只能说明其有酸性,但是不能说明HF是弱酸;
⑧pH=3的强酸稀释至原体积的10倍,pH值将增大1个单位。pH=3的HF溶液稀释至原体积的10倍,pH值减小0.6,不能说明HF是弱酸;
⑨等物质的量浓度的HCl溶液和HF溶液与足量锌粒反应,产生氢气的量一样多,只能说明两种一元酸的物质的量相同,不能说明HF是弱酸。
综上所述,一定能说明HF是弱酸的是①③④,故选A。


科目:高中化学 来源: 题型:
【题目】配合物X{[Cu(phen)(Thr)(H2O)]ClO4}能够通过插入或部分插入的模式与DNA作用,它可由Cu(ClO4)2、HThr(结构简式如图l所示)、phen等为原料制备。
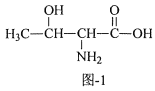
(1)Cu2+基态电子排布式为___。
(2)ClO4-的空间构型为__(用文字描述),与ClO4-互为等电子体的一种分子的化学式为___。
(3)HThr分子中,碳原子的杂化类型为___;1molHThr中含有σ键的数目为___。
(4)配合物X中配离子的结构如图2所示,则配位原子为___(填元素符号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见含硫物质A~D,在生活、生产中有着广泛应用,它们之间的转化关系如下图所示。其中反应①、②中所需物质B溶液的浓度不同。
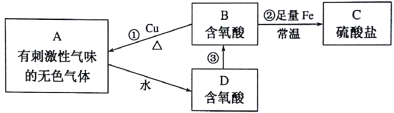
请按要求回答下列问题:
(1)A的化学式为_______。
(2)反应①、②中Cu、Fe所起的作用相同,即都作_______(填“氧化剂”或“还原剂”),你判断的依据是它们都是金属,在反应中都_______。
(3)反应②的离子方程式为_______。
(4)大气中因废气A引起酸雨的反应流程之一可用下图示意:
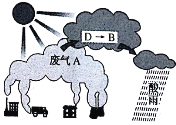
上图中由D→B的转化所需氧化剂为_______。
当将含D的雨水敞口放置一段时间后(忽略溶液体积、温度的变化),其c(H+)将_______。(填“增大”“减小”或“不变”)。废气A是一种重要的化工原料,常采用氨吸收法进行循环利用、变废为宝。某工厂若将4.48×106L(标准状况下)废气A进行环保处理,完全转化为 NH4HSO3时,需消耗10mol/L氨水溶液(溶质全部以NH3H2O计)的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-38 |
回答下列问题:
(1)该电池的正极反应式为___,电池反应的离子方程式为:___。
(2)维持电流强度为0.5A,电池工作十分钟,理论上消耗Zn___g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过__分离回收;滤渣的主要成分是MnO2、___和___,欲从中得到较纯的MnO2,最简便的方法是在空气中加热,其原理是___。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为__,加碱调节至pH为__时,铁刚好完全沉淀;继续加碱调节至pH为___时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是___,原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液HA、HB各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
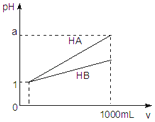
A.同浓度、同体积的HA、HB溶液分别加入过量的锌粒,产生的氢气体积后者大
B.pH相同的HA、HB溶液,物质的量浓度HA<HB
C.若1<a<4,则HA、HB都是弱酸
D.体积相同pH均为1的HA、HB溶液分别滴加同浓度的NaOH溶液至中性,前者消耗的NaOH少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大 气相通,B区为封闭体系并有N2保护。下列关于该电池的说法错误的是( )
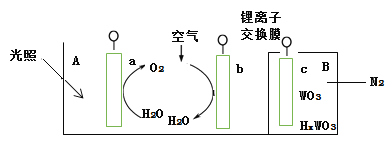
A.若用导线连接a、c,则a为负极,该电极附近pH减小
B.若用导线连接a、c,则c电极的电极反应式为HxWO3 - xe- =WO3 + xH+
C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化
D.若用导线连接b、c, b电极的电极反应式为O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F可用于某抗凝血药的制备,工业生成F的一种路线图如下(其中H与FeCl3溶液能发生显色反应):
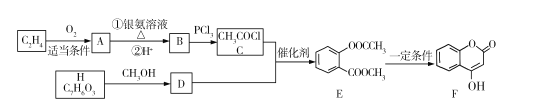
回答下列问题:
(1)A的名称是 ___,E中的官能团是名称是____。
(2)B→C的反应类型是 ___,F的分子式为____。
(3)H的结构简式为 ___。
(4)E与NaOH溶液反应的化学方程式为 ___。
(5)同时满足下列条件的D的同分异构体共有____种,写出核磁共振氢谱有5组峰的物质的结构简式 ___
①是芳香族化合物
②能与NaHCO3溶液反应
③遇到FeCl3溶液不显色
④1mol该物质与钠反应时最多可得到1molH2
(6)以2氯丙酸、苯酚为原料制备聚丙烯酸苯酚酯(![]() ),写出合成路线图(无机试剂自选)_________。
),写出合成路线图(无机试剂自选)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是
A. 3g 3He含有的中子数为1NA
B. 1 L 0.1 mol·L1磷酸钠溶液含有的![]() 数目为0.1NA
数目为0.1NA
C. 1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D. 48 g正丁烷和10 g异丁烷的混合物中共价键数目为13NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,按要求回答问题:
① |
| ||||||||||||||||
|
|
| ② | ③ | ④ |
|
| ||||||||||
⑤ | ⑥ |
|
|
|
|
|
|
|
|
|
| ⑦ |
|
| ⑧ | ⑨ |
|
(1)元素④在周期表中位置是_______。元素③的最高价氧化物的化学式为________。
(2)元素①⑤组成化合物电子式为___________。
(3)元素②的单质与⑧的最高价氧化物的水化物热的浓溶液反应的化学方程式为___。
(4)元素⑦与⑨形成的化合物与元素③的氢化物的水溶液反应的离子方程式为_____。
(5)元素④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为_____(用离子符号表示)。
(6)A—F发生如图所示的转化,A、B、C、D为①—⑨中某种元素形成的单质,E、F、G为B、C、D与A形成的二元化合物,G是一种常见温室气体,与B可以反应生成E,E中B元素的质量分数为60%,F为两性物质。

①A和F的化学式分别为_______、_______。
②B与G反应的化学方程式为____________________。
③C与NaOH溶液反应的离子方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com