
| A. | 1.06g | B. | 2.63g | C. | 3.6g | D. | 5.3g |
科目:高中化学 来源: 题型:解答题
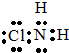 ,从物质结构的角度解释两者熔点相差较大的原因氯胺NH2Cl为分子晶体,NH4Cl为离子晶体,熔沸点离子晶体高于分子晶体.
,从物质结构的角度解释两者熔点相差较大的原因氯胺NH2Cl为分子晶体,NH4Cl为离子晶体,熔沸点离子晶体高于分子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.8g液态KHSO4中含有0.1NA个阳离子 | |
| B. | NA个Fe(OH)3胶体粒子形成的纳米材料的质量为107g | |
| C. | 等体积等密度的N2和CO所含分子数相同 | |
| D. | 含NA个Na+的Na2O溶解于水1L水中,Na+的物质的量浓度为1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固态氯化钠不导电,所以NaCl是非电解质 | |
| B. | 氨气的水溶液能导电,所以氨气是电解质 | |
| C. | SO3溶于水能导电,是因为SO3在水中发生了电离 | |
| D. | 液态氯化氢不导电,但是HCl是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
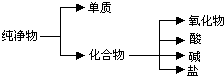 (1)纯净物根据其组成和性质可进行如图分类:
(1)纯净物根据其组成和性质可进行如图分类:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com