
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
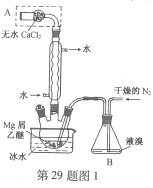
步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160 ℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是____________。
实验中不能用干燥空气代替干燥N2,原因是___________。
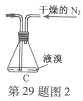
(2)如将装置B改为装置C(图2),可能会导致的后果是___________。
(3)步骤3中,第一次过滤除去的物质是___________。
(4)有关步骤4的说法,正确的是___________。
A.可用95%的乙醇代替苯溶解粗品
B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯
D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:
Mg2++ Y4-====Mg Y2-
①滴定前润洗滴定管的操作方法是__________。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是________________________(以质量分数表示)。
【答案】(1)干燥管 防止镁屑与氧气反应,生成的MgO阻碍Mg和Br2的反应
(2)会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患
(3)镁屑
(4)BD
(5)①从滴定管上口加入少量待测液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复2-3次
②97.5%
【解析】
试题分析:(1)仪器A为干燥管。本实验要用镁屑和液溴反应生成无水溴化镁,所以装置中不能有能与镁反应的气体,例如氧气,所以不能用干燥的空气代替干燥的氮气。故答案为:防止镁屑与氧气反应,生成的MgO阻碍Mg和Br2的反应。(2)将装置B该为装置C,当干燥的氮气通入,会使气压变大,将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患。而装置B是利用干燥的氮气将溴蒸气代入三颈烧瓶中,反应可以控制,防止太快。(3)步骤3过滤出去的是不溶于水的镁屑。(4)A、95%的乙醇中含有水,溴化镁有强烈的吸水性,错误;B、加入苯的目的是除去乙醚和溴,洗涤晶体用0℃的苯,可以减少产品的溶解,正确;C、加热至160℃的主要目的是分解三乙醚合溴化镁得到溴化镁,不是为了除去苯,错误;D、该步骤是为了除去乙醚和溴,故正确。故选BD。(5)①滴定前润洗滴定管是需要从滴定管上口加入少量待测液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复2-3次。②根据方程式分析,溴化镁的物质的量为0.0500×0.02650=0.001325mol,则溴化镁的质量为0.001325×184=0.2438g,溴化镁的产品的纯度=0.2438/0.2500=97.5%。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】在国际环境问题中,一次性使用的聚苯乙烯材料带来的“白色污染”甚为突出。这种材 料难以分解,处理麻烦。最近研究制出一种新型的材料能替代聚苯乙烯。它是由乳酸缩 聚而生成的,该种材料可在乳酸菌作用下发生降解,下列关于聚乳酸的说法正确的是
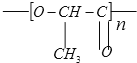
A.聚乳酸是一种纯净物
B.其聚合方式与聚苯乙烯相似
C.其单体为CH3-CH(OH)-COOH
D.聚乳酸是一种线型高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照一定标准,根据物质与水反应的不同情况,对下列物质进行分类,如图所示,请填空:

(1)上图中分类标准1(分成A、B组的依据)为______________________________。
(2)工业上常用D组中________(填化学式)来消除C组中物质对大气的污染,涉及反应的化学方程式为______________________________ 。
(3)实验室由Al3+制备Al(OH)3时,应选择D组中________(填化学式)的水溶液,
离子方程式为______________________________________。
(4)F组中有两种物质,在工业上均有重要的用途,请各写出一个化学方程式表示其用途:
__________________________________、__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.由 D和18O所组成的水11g,所含中子数为4NA
B.1 L 0.4 mol·L-1稀硝酸与Fe完全反应,转移电子数为0.3NA
C.标准状况下,2.24LCHCl3所含分子数为 0.1NA
D.密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机推断题。有机物G是一种医药中间体,可通过如图所示路线合成。A的产量是衡量一个国家石油化工发展水平的重要标志,H的分子式是C7H8。
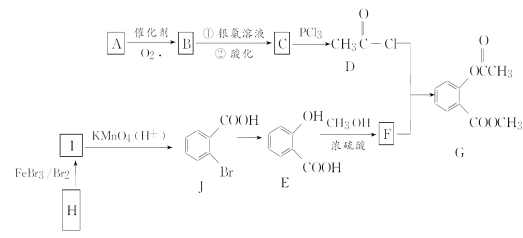
已知:![]()
请回答以下问题:
(1)A的结构简式是________。
(2)H→I的化学反应方程式为___ _____,
E→F的化学方程式为_________________ ______________。
(3)C→D的反应类型是________,I→J的反应类型是________。
(4)两个E分子在一定条件下发生分子间脱水生成一种环状酯的结构简式是_________。
(5)满足以下条件的F的同分异构体还有________种(不包含F)。
①能与氯化铁溶液发生显色反应
②红外光谱等方法检测分子中有“COO”结构
③苯环上有两个取代基
其中能与碳酸氢钠溶液反应且核磁共振氢谱测定有5个吸收峰的同分异构体的结构简式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。

完成下列填空:
(1)实验时,通常加入过量的乙醇,原因是______________。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是_______________;浓硫酸用量又不能过多,原因是____________。
(2)饱和Na2CO3溶液的作用是_______________。
(3)反应结束后,将试管中收集到的产品倒入分液漏斗中,_________、________,然后分液。
(4)若用b装置制备乙酸乙酯,其缺点有__________、__________。由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是________,分离乙酸乙酯与该杂质的方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】19世纪中叶,俄国化学家门捷列夫( )
A. 提出了原子分子学说 B. 提出了元素周期律
C. 制出了第一张元素周期表 D. 发现了质量守恒定律
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是 ( )
A. 利用质谱法
B. 利用红外光谱法
C. 利用核磁共振氢谱
D. 利用金属钠或者金属钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用金属活动性的不同,可以采取不同的冶炼方法冶炼金属。下列反应所描述的冶炼方法不可能实现的是( )
A. 2Al2O3(熔融)![]() 4Al+3O2↑
4Al+3O2↑
B. Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
C. Fe+CuSO4 =FeSO4+Cu
D. 2NaCl(水溶液)![]() 2Na+Cl2↑
2Na+Cl2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com