
下列各组在溶液中的反应,不管反应物量的多少,都只能用同一个离子方程式来表示的是
A.FeBr2与Cl2
B. HCl与Na2CO3
C.Ba(OH) 2与H2SO4
D.Ca(HCO3) 2与NaOH
科目:高中化学 来源:2016届河南省高三上学期第八次大考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.已知电离平衡常数:H2CO3>HClO>HCO3—,向NaClO溶液中通入少量CO2:2ClO—+CO2+H2O=2HClO+CO32—
B.向硫酸氢钠溶液中滴加Ba(OH)2至中性:H++SO42-+Ba2++ OH-=BaSO4↓+ H2O
C.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3+ + 2I-=2Fe2+ + I2
D.硫氢根离子的电离方程式:HS-+H2O H3O++S2-
H3O++S2-
查看答案和解析>>
科目:高中化学 来源:2015-2016浙江宁波效实中学高一上期中考试化学试卷(解析版) 题型:选择题
某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3(2三种杂质中的一种或两种,现将6.9 g样品溶于足量水中,得到澄清溶液,若再加入过量的CaCl2溶液,得到4.5g沉淀,对样品所含杂质的正确判断是
A.肯定有KNO3和Na2CO3,没有Ba(NO3(2
B.肯定有KNO3,没有Ba(NO3(2,可能还有Na2CO3
C.肯定没有Na2CO3和Ba(NO3(2,可能有KNO3
D.以上判断都不正确
查看答案和解析>>
科目:高中化学 来源:2015-2016宁夏回族自治银川一中高一上期中考试化学试卷(解析版) 题型:选择题
某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
A.2∶1 B.1∶2 C.1∶4 D.3∶2
查看答案和解析>>
科目:高中化学 来源:2016届北京市朝阳区高三上学期期中统考化学试卷(解析版) 题型:选择题
人体血液呈弱碱性,pH在7.35~7.45之间,超出范围会引起酸或碱中 毒。
毒。
下列有关血液说法不合理的是
A.血液中溶解的CO2有平衡存在:CO2 + H2O  H2CO3
H2CO3  H++HCO3-
H++HCO3-
B.当pH<7.35时造成酸中毒,可静脉滴注NaHCO3溶液解毒
C.病人心肺复苏时大量使用NaHCO3,会造成血液的pH升高,引起碱中毒
D.取一定量pH=8.1的血液稀释到原体积的10倍,pH=7.1
查看答案和解析>>
科目:高中化学 来源:2016届贵州省遵义市高三上学期第一次联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.SO2、NO、SiO2都是酸性氧化物
B.PM2.5是指大气中直径接近于2.5×l0 -6m的颗粒物,它在空气中形成气溶胶
C.向蛋白质溶液中滴加CuSO4溶液产生沉淀属于化学变化
D.KCl和SO3溶于水后均能导电,是因为KC1和SO3都为电解质
查看答案和解析>>
科目:高中化学 来源:2016届山东省德州市高三上学期期中测试化学试卷(解析版) 题型:选择题
现将足量的CO2气体不断通人到含KOH、Ba(OH)2、K[Al(OH)4]的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
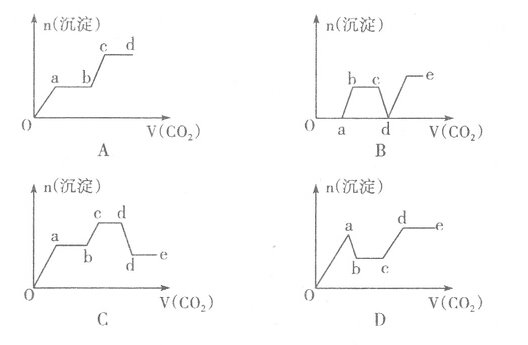
查看答案和解析>>
科目:高中化学 来源:2016届山西省晋中市四校高三上学期期中联考化学试卷(解析版) 题型:选择题
四种短周期元素在周期表中的位置如右图,其中只有M元素原子最外层电子数与电子 层数相等,下列说法不正确的是
Y | Z | ||
M | X |
A.原子半径Z<M
B.非金属性:X<Z
C.M元素最高价氧化物对应水化物具有两性
D.Y的最高价氧化物对应水化物的酸性比X的弱
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期期中模块测试化学试卷(解析版) 题型:填空题
I 铁及其化合物之间的相互转化可用下式表示:
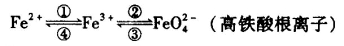
回答下列有关问题:
(1)检验硫酸铁溶液中是否存在Fe2+的方法是___________________。
(2)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2 = 2Na2FeO4+2Na2O+2Na2SO4+O2↑
该反应中的还原剂是___________,每生成l mol Na2FeO4转移____________mol电子。
(3)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:
Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:_______________。
②若反应过程中转移了0.3 mol电子,则还原产物的物质的量为___________。
II某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备 。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
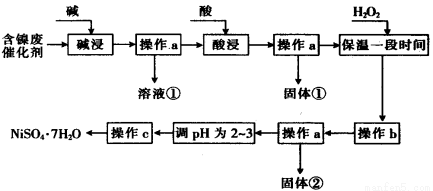
部分阳离子以氢氧化物形式沉淀时的pH如下:

(1)“碱浸”过程中发生反应的离子方程式是
(2)“酸浸”时所加入的酸是 (填化学式)。
(3)加入H2O2时发生反应的离子方程式为
(4)操作b为调节溶液的pH,你认为pH的调控范围是
(5)NiS04·7Hz0可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com