
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和lmolO2;(乙) lmolSO2和0.5molO2;(丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3(g) △H=-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和lmolO2;(乙) lmolSO2和0.5molO2;(丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
A. 容器内压强P:P甲=P丙>2P乙
B. SO3的质量m:m甲=m丙>2m乙
C. c(SO2)与c(O2)之比 k:k甲=k丙>k乙
D. 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
【答案】B
【解析】试题分析:恒温恒容,甲与乙起始n(SO2):n(O2)=2:1,甲等效为在乙的基础上增大一倍压强,平衡向正反应移动,转化率增大;丙按化学计量数转化到左边可得n(SO2)=2mol,n(O2)=1mol,与甲为等效平衡,平衡时对应各组分的物质的量相等。A、甲与丙为等效平衡,平衡时对应各组分的物质的量相等,故压强P甲=P丙,甲等效为在乙的基础上增大一倍压强,平衡向正反应移动,故P乙<P甲<2P乙,故P甲=P丙<2P乙,A错误;B、甲与丙为等效平衡,平衡时对应各组分的物质的量相等,故质量m甲=m丙,甲等效为在乙到达平衡的基础上,再加入1mol SO2和0.5mol O2,增大压强,平衡向正反应移动,SO2转化率增大,m甲>2m乙,故m甲=m丙>2m乙,B正确;C、对于甲、乙,SO2、O2起始物质的量之比等于化学计量数之比,c(SO2)与c(O2)之比为定值2:1,丙为分解反应,丙中c(SO2)与c(O2)之比为2:1,故k甲=k丙=k乙=2,C错误;D、甲与丙为等效平衡,平衡时对应各组分的物质的量相等,故Q甲+Q丙=197,甲等效为在乙的基础上增大一倍压强,平衡向正反应移动,SO2转化率增大,故Q甲>2Q乙,D错误;答案选B。


科目:高中化学 来源: 题型:
【题目】乙烯可用作合成纤维、合成橡胶、合成塑料的原料。回答下列问题:
(1)实验室用乙醇和五氧化二磷制取乙烯的过程如下:
P2O5+3H2O=2H3PO4
H3PO4+C2H5OH→C2H5OPO(OH)2(磷酸单乙醋)+H2O;
170~200 ℃时,C2H5OPO(OH)2会分解生成乙烯和磷酸。
C2H5OPO(OH)2分解反应的化学方程式为___________________。
(2)向2 L的恒容密闭容器中充入0.1mol C2H6和0.1 molCO2,发生的反应为
C2H6 (g)+CO2(g)![]() C2H4(g)+CO(g)+H2O(g),C2H6的平衡转化率与温度的关系如图所示。
C2H4(g)+CO(g)+H2O(g),C2H6的平衡转化率与温度的关系如图所示。

①在相应温度下,A点的反应速率v(正)________(填“>”“<”或“=”)v(逆)。
②若不考虑副反应的发生,为提高C2H6的平衡转化率,除了将生成物及时从体系中分离出来外,还可采取的措施有________________ (任写一种)。
③720℃时,上述反应的平衡常数K=______________。
(3)用CrO3作催化剂,CO2重整C2H6制乙烯的反应过程如下:
C2H6(g)![]() C2H4(g)+H2(g) △H1 ;
C2H4(g)+H2(g) △H1 ;
3H2(g)+2CrO3(s)=3H2O(g)+Cr2O3(s) △H2 ;
Cr2O3(s)+3CO2(g)=3CO(g)+2CrO3(s) △H3。
①反应:C2H6(g)+CO2(g)![]() C2H4(g)+ CO2(g) +H2O(g)的△H=____________(用含△H1、△H2、△H3的代数式表示)。
C2H4(g)+ CO2(g) +H2O(g)的△H=____________(用含△H1、△H2、△H3的代数式表示)。
②已知部分化学键的键能数据如下表所示,则△H1=__________kJ·mol-1。
化学键 | C-C | C=C | C-H | H-H |
键能/kJ mol-1 | 348 | 615 | 413 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去乙醇中溶解的微量食盐可采用_____的方法。除去 Fe2O3 中混有的 A12O3 杂质的试剂是__________,对应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置进行相应的实验,不能达到实验目的的是

A. 利用图甲装置,可快速制取氨气
B. 利用图乙装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液
C. 利用图丙装置,可制取乙烯并验证其易被酸性KMnO4溶液氧化
D. 利用图丁装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温室下,用0.1molL﹣1NaOH溶液分别滴定体积均为20ml浓度均为0.1molL﹣1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( ) 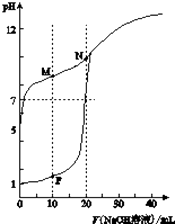
A.HX为弱酸
B.M点c(HX)﹣c(X﹣)>c(OH﹣)﹣c(H+)
C.将P点和N点的溶液为混合,呈酸性
D.向N点溶液中通入HCl至pH=7:c(Na+)>c(HX)=c(Cl﹣)>c(X﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是 ( )
A. 氢氧化铝与盐酸反应:H++OH-=H2O
B. 碳酸钙与稀硝酸反应:CO32-+2H+=H2O+CO2↑
C. 锌与稀硫酸反应:Zn+2H+=Zn2++H2↑
D. 氯化镁溶液与氢氧化钠溶液反应:Mg2++OH-=Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2的催化氧化是工业制取硫酸的关键步骤之一,该反应的化学方程式为:2SO2+O2![]() 2SO3,
2SO3,
△H<0。请回答下列问题:
(1)判断该反应达到平衡状态的标志是__________(填字母)。
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
(2)当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的
是______________(填字母)。
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.降低温度
(3)将0.050 mol SO2 (g)和0.030 mol O2 (g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(SO3) =0.040mol/L。计算该条件下反应的平衡常数K和SO2的转化率(不必写出计算过程)。
①平衡常数K=______________;
②平衡时,SO2的转化率α (SO2) =_____________。
(4)SO2尾气常用饱和Na2SO3溶液吸收,减少SO2气体污染并可得到重要的化工原料NaHSO3。己知NaHSO3溶液同时存在以下两种平衡:①HSO3-![]() SO32-+H+ ②HSO3-+H2O
SO32-+H+ ②HSO3-+H2O![]() H2SO3+OH-、常温下,0.1 mol/LNaHSO3溶液的 pH<7,则该溶液中 c (H2SO3)__________c (SO32-)(填“>”或“=”或“<”下同)。
H2SO3+OH-、常温下,0.1 mol/LNaHSO3溶液的 pH<7,则该溶液中 c (H2SO3)__________c (SO32-)(填“>”或“=”或“<”下同)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com