
科目:高中化学 来源: 题型:阅读理解
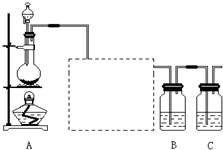 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 氢氧化钡的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 12 |
| ② | 22.00 | 18.00 | 11 |
| ③ | 22.00 | 22.00 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 氢氧化钡的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
查看答案和解析>>
科目:高中化学 来源:0127 期末题 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)(1)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中c (Na+)> c (CN-),用“>、<、=”符号填空
①溶液中c (OH -) c (H +) ②c (HCN) c (CN-)
(2)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在此过程中,溶液的碳酸氢根离子浓度变化趋势可能是:(A)逐渐减小;(B)逐渐增大;(C)先逐渐增大,而后减小;(D)先逐渐减小,而后增大. 你的选择是
(3)pH值相同的 ①HCl(aq)、 ②H2SO4(aq)、 ③ CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是 。
②分别用0.1 mol/L的NaOH(aq)中和,其中消耗NaOH(aq)最多的是 。
③反应开始时,反应速率 。(填A、HCl最快;B、H2SO4最快;C、CH3COOH最快;D、一样快)
(4)某温度下,纯水中c (H+)=2.0×10-7 mol/L,则此时c (OH-) = mol/L。相同条件下,测得① NaHCO3(aq)② CH3COONa(aq)③ NaClO(aq)三种稀溶液的pH值相同。那么,它们的物质的量浓度由大到小的顺序是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com