
 CH3OH
CH3OH
 CH3OH��g����ƽ�ⳣ��Ϊ ��10min�������ڵ�ѹǿ��Ϊԭ���� �����ı����������������COת���ʵ��� ��
CH3OH��g����ƽ�ⳣ��Ϊ ��10min�������ڵ�ѹǿ��Ϊԭ���� �����ı����������������COת���ʵ��� �� CH3OH��g����ƽ�ⳣ��Ϊ12��10min�������ڵ�ѹǿ��Ϊԭ����0.5���������COת���ʵ��Ǽ�ʹƽ��������Ӧ�����ƶ����У�A��D��E���֣�
CH3OH��g����ƽ�ⳣ��Ϊ12��10min�������ڵ�ѹǿ��Ϊԭ����0.5���������COת���ʵ��Ǽ�ʹƽ��������Ӧ�����ƶ����У�A��D��E���֣�

 ʱ�����������ҵԭ���ܳ�����ϵ�д�
ʱ�����������ҵԭ���ܳ�����ϵ�д� ����νӽ̲���ĩ���Ԥϰ�人������ϵ�д�
����νӽ̲���ĩ���Ԥϰ�人������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
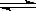 2NH3��g������H��0���ﵽ��ƽ�⡣�ڽ��ı�ijһ�����ﵽ��ƽ�⣬�ı����һ������
2NH3��g������H��0���ﵽ��ƽ�⡣�ڽ��ı�ijһ�����ﵽ��ƽ�⣬�ı����һ������| A�������ʵ����� | B�������¶� | C������Ӧ���Ũ�� | D������ѹǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ںϳɰ���ƽ����ϵ�У�һ������N2��H2��NH3�������� |
| B��BaSO4�ij����ܽ�ƽ���У��������ܽ��BaSO4���� |
| C���ڴ�����Һ�У�һ������H+��OH-��CH3COO-��CH3COOH���ӡ�H2O���� |
D����ƽ����ϵFeCl3+3KSCN Fe(SCN)3+3KCl�м���KCl���壬ƽ�⽫���淴Ӧ�����ƶ�����Һ��ɫ����dz Fe(SCN)3+3KCl�м���KCl���壬ƽ�⽫���淴Ӧ�����ƶ�����Һ��ɫ����dz |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)����H<0����ƽ�������������¶Ƚ��ͣ����������в���ȷ����
2C(g)����H<0����ƽ�������������¶Ƚ��ͣ����������в���ȷ����| A�������л�������ƽ����Է����������� |
| B������Ӧ���������淴Ӧ���ʼ�С��ƽ��������Ӧ�����ƶ� |
| C������Ӧ���ʺ��淴Ӧ���ʶ���С��C�İٷֺ������� |
| D����������ܶȵı仯�����������Ϊ�жϷ�Ӧ�Ƿ��ٴδ�ƽ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
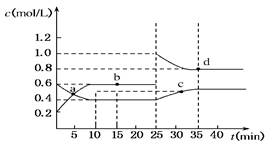
| A����Ӧ���е�10 minʱ����ϵ���յ�����Ϊ9.68 kJ |
| B��ǰ10 min�ڣ���v(NO2)��ʾ�ķ�Ӧ����Ϊ0.02 mol/(L��min) |
| C��a��b��c��d�ĵ���v����v������� |
| D��25 minʱ������ƽ���ƶ���ԭ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

 ?CO2(g)��NO(g)��Ӧ�����������仯ʾ��ͼ��һ�������£��ڹ̶��ݻ����ܱ������и÷�Ӧ�ﵽƽ��״̬�����ı�����һ������X��Y��X�ı仯��ϵ������ͼ�������й�˵����ȷ����(����)
?CO2(g)��NO(g)��Ӧ�����������仯ʾ��ͼ��һ�������£��ڹ̶��ݻ����ܱ������и÷�Ӧ�ﵽƽ��״̬�����ı�����һ������X��Y��X�ı仯��ϵ������ͼ�������й�˵����ȷ����(����)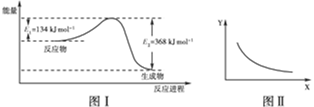
| A���÷�Ӧ���ʱ䦤H����234 kJ��mol��1 |
| B����X��ʾ��ϵ��ѹǿ����Y��ʾ�Ŀ�����NO2��ת���� |
| C����X��ʾ�¶���Y��ʾ�Ŀ�����CO2���ʵ���Ũ�� |
| D������CO����ʼŨ�ȣ�ƽ��������Ӧ�����ƶ�����Ӧ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO(g) + H2(g)
CO(g) + H2(g) 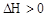 ���ı�������������1���������¶ȣ�����Ӧ���� ���淴Ӧ���� ����������С�䣩��ƽ�� �ƶ���
���ı�������������1���������¶ȣ�����Ӧ���� ���淴Ӧ���� ����������С�䣩��ƽ�� �ƶ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
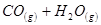

 ��H
��H
 ����ʹ
����ʹ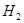 ��ƽ��Ũ������һ������������������ʱ�����д�ʩ���Բ��õ���
��ƽ��Ũ������һ������������������ʱ�����д�ʩ���Բ��õ���| A�������¶� | B���ټ��� |
C���ټ��� �� �� | D���ټ��� �� �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com