
【题目】电解质溶液电导率越大导电能力越强,常温下用0.100 mol/L盐酸分别滴定10.00 mL浓度均为0.100 mol/L的NaOH溶液和氨水。利用传感器测得滴定过程中溶液的电导率如图所示,下列说法不正确的是( )
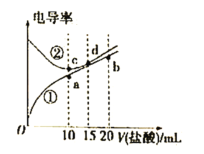
A.曲线②代表滴定氢氧化钠溶液的曲线
B.滴定氨水的过程应该选择甲基橙作为指示剂
C.b点溶液中:c(H+)<c(OH-)+c(NH4+)+c(NH3·H2O)
D.a、b、c、d四点的溶液中,水的电离程度最大的是a点
【答案】C
【解析】
从图中可以看出,在加入盐酸前,曲线②的电导率大,则表明溶液中离子浓度大,曲线②表示NaOH溶液的电导率;曲线①表示氨水的电导率。在两份电解质溶液中,NaOH与一水合氨的物质的量相同,则加入盐酸10mL时刚好完全反应,溶质分别为NaCl和NH4Cl;继续滴加盐酸,则盐酸过量,不发生化学反应。
A.由以上分析知,由于曲线②的电导率强,表明溶液的导电能力强,离子浓度大,从而得出曲线②代表滴定氢氧化钠溶液的曲线,A正确;
B.氨水与盐酸反应的最终产物为NH4Cl,水溶液显酸性,所以应该选择甲基橙作为指示剂,B正确;
C.滴加盐酸至b点时,溶液中n(NH4Cl)=n(HCl),溶液显酸性,根据电荷守恒可知c(H+)+c(NH4+)=c(OH-)+c(Cl-),根据物料守恒可知2c(NH4+)+2c(NH3·H2O)=c(Cl-),因此c(H+)=c(OH-)+c(NH4+)+2c(NH3·H2O),所以c(H+)>c(OH-)+c(NH4+)+c(NH3·H2O),C不正确;
D.a、b、c、d四点的溶液中,a点为NH4Cl溶液,c点为NaCl溶液,d点为NaCl、HCl混合溶液,b点为NH4Cl、HCl混合溶液,所以只有a点水的电离受到促进,水的电离程度最大,D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】实验室中,可由钙在纯氧下加热制得![]() ,反应装置如图所示,关于实验操作或叙述错误的是( )
,反应装置如图所示,关于实验操作或叙述错误的是( )
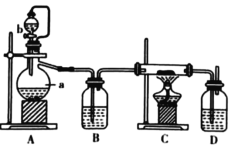
A.若a中装有少量二氧化锰固体,则b中试剂为过氧化氢溶液
B.打开分液漏斗活塞,当A中产生的气体充满整个装置后,再点燃C处酒精灯
C.反应结束后,将装置C中所得固体物质加入过量水中,有无色无味气体生成,说明C中所得固体全部为![]()
D.装置D中装有的浓硫酸可以防止空气中的水蒸气和二氧化碳进入C中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的相对分子质量为128,燃烧只生成CO2和H2O,已知A中含有一个六元碳环且A可与NaHCO3溶液反应,则该有机物碳环上一氯代物的数目为(不考虑立体异构)( )
A.2B.3C.4D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
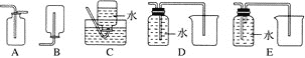
(4)以下收集NO气体的装置,合理的是________(填序号)。
(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1.0mol·L -1NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积(V)关系如右图所示,则原硫酸溶液的物质的量浓度和恰好完全反应后溶液的总体积分别是(设二者混合后体积为二者体积之和)
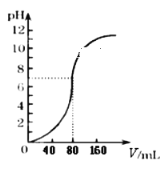
A. 0.5mol·L-1 80mLB. 0.5mol·L-1 160mL
C. 1.0mol·L-1 80mLD. 1.0mol·L-1 160mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,纯水中存在的平衡:H2O ![]() H+ + OH-,下列叙述正确的是
H+ + OH-,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 加入稀盐酸,平衡逆向移动,c(H+)降低
C. 加入氢氧化钠溶液,平衡逆向移动,Kw变小
D. 加入少量固体CH3COONa,平衡正向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向c(H+)=1×10-6mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液中c(H+)=1×10-3mol·L-1。下列对该溶液的叙述不正确的是( )
A.该温度高于25℃
B.![]() 的电离方程式为NaHSO4=Na++H++SO42-
的电离方程式为NaHSO4=Na++H++SO42-
C.加入NaHSO4晶体抑制了水的电离
D.由水电离出来的H+的浓度为1×10-12mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于氧化还原反应的是
A. AgNO3+NaCl===AgCl↓+NaNO3 B. 3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
C. 2F2+2H2O===4HF+O2 D. MgCl2(熔融) ![]() Mg+Cl2↑
Mg+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用蒈烯(A)为原料可制得杀虫剂菊酯(H),其合成路线可表示如图。
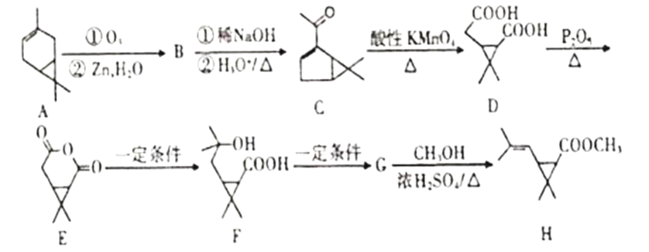
已知①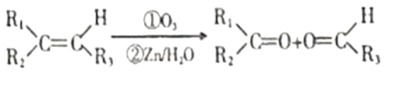
②R1CHO+R2CH2CHO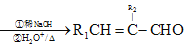 +H2O
+H2O
(1)A的分子式为___。
(2)B的结构简式___。
(3)C中含氧官能团名称为___。
(4)由D生成E,F生成G的反应类型分别是____和_____。
(5)写出由G生成H的化学方程式为____。
(6)满足下列条件D的同分异构体有___种。(不考虑立体异构)
①1molD与碳酸氢钠溶液反应生成标准状况下22.4LCO2气体;
②D分子与稀硫酸共热可水解生成异丙醇;
③该化合物能使溴水褪色。
(7)写出以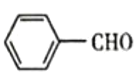 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备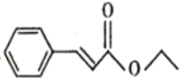 的合成路线流程图(无机试剂任用)___。
的合成路线流程图(无机试剂任用)___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com