
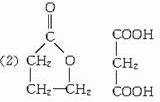
已知:①相对分子质量的关系:M(F)=M(I),M(B)>M(C)
②—OH和—Cl不能连接在同一个碳原子上。
请回答:
(1)B中所含官能团的名称:_____________________;
(2)写出下列物质的结构简式:H_______________I_______________;
(3)与C互为同类物质的同分异构体结构简式为__________________;
(4)写出下列反应的化学方程式和反应类型:
F→G__________________________________;___________反应
A→D+E_______________________________;____________反应
(1)氯原子、羧基

(3)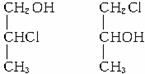
![]()
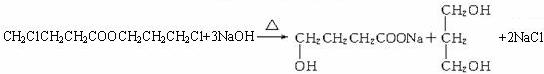 水解(或取代)
水解(或取代)
解析:五元环酯H至少含4个碳原子,与H碳原子相同的D也至少含有4个碳原子。八元环酯J至少含6个碳原子,生成J的E、I碳原子数相同,E至少含3个碳原子。又因D、E是A(C7H12O2Cl2)仅有的两种水解产物,两者碳原子数之和为7,可知D含4个碳原子,E含3个碳原子,进一步可知F、H含有4个碳原子,K、I含有3个碳原子。含4个碳原子的H为五元环酯,其结构只能为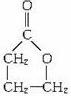 ,酯化生成H的F为HOCH2CH2CH2COOH,F生成的聚酯G为
,酯化生成H的F为HOCH2CH2CH2COOH,F生成的聚酯G为![]() 。酸化生成F的D为HOCH2CH2CH2COONa,D所含醇羟基应由—Cl水解而来,由D可知A含片段
。酸化生成F的D为HOCH2CH2CH2COONa,D所含醇羟基应由—Cl水解而来,由D可知A含片段![]() 。I(CnHm-4O4)由E(CnHmO2)氧化生成,对比两者组成,可知E含2个醇羟基且都在端点碳原子上,则E为
。I(CnHm-4O4)由E(CnHmO2)氧化生成,对比两者组成,可知E含2个醇羟基且都在端点碳原子上,则E为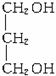 ,进一步可知K为
,进一步可知K为![]() ,I为
,I为![]() ,J为
,J为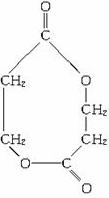 。E所含2个醇羟基中的一个应由-Cl水解而来,据此可知A含片段-OCH2CH2CH2Cl,则A的结构为
。E所含2个醇羟基中的一个应由-Cl水解而来,据此可知A含片段-OCH2CH2CH2Cl,则A的结构为![]() 。A酸性水解产物M(B)>M(C),可知B为ClCH2CH2CH2COOH,C为HOCH2CH2CH2Cl。
。A酸性水解产物M(B)>M(C),可知B为ClCH2CH2CH2COOH,C为HOCH2CH2CH2Cl。


科目:高中化学 来源: 题型:
 已知A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大.A和B可形成常见化合物BA4,一个BA4分子中电子总数为10;C原子的最外层电子数是核外电子总数的
已知A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大.A和B可形成常见化合物BA4,一个BA4分子中电子总数为10;C原子的最外层电子数是核外电子总数的| 3 |
| 4 |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 一定条件 |
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
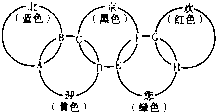 “北、京、欢、迎、您”分别代表五种不同颜色的单质,它们之间相互交叉形成了如图所示的奥运五环旗,A、B、C、D、E、F、G、H是由相交叉的两环元素组成的化合物.
“北、京、欢、迎、您”分别代表五种不同颜色的单质,它们之间相互交叉形成了如图所示的奥运五环旗,A、B、C、D、E、F、G、H是由相交叉的两环元素组成的化合物.| 3 |
| 2 |
| 5 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 反应过程 | 化学方程式 | △H(kJ?mol-1) |
| 甲醇合成反应 | 2H2(g)+CO(g)=CH3OH(g) | -90.8 |
| 水煤气变换反应 | CO(g)+H2O(g)═CO2(g)+H2(g) | -41.3 |
| 甲醇脱水反应 | 2CH3OH(g)=CH3OCH3(g)+H2O(g) | -23.5 |
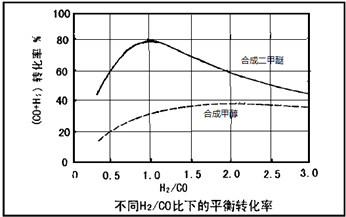
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省金华十校高考模拟考试理综化学试卷(解析版) 题型:填空题
2013年雾霾天气多次肆虐我国中东部地区。其中汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作KP),则该反应的KP=-???????????????? 。
②该反应在低温下能自发进行,该反应的ΔH ????????? 0。(选填“>”、“<”)
③在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知:t2 --tl=t3-t2)。

则下列说法不正确的是????????? 。(填编号)
A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:tl~t2>t2~t3
(2)煤的综合利用、使用清洁能源等有利于减少环境污染。合成氨工业原料气的来源之一水煤气法,在催化剂存在条件下有下列反应:
①
②
③
①△H3和△H1、△H2的关系为△H3=???????????? 。
②在恒温条件下,将l mol CO和1 mol H2O(g)充入某固定容积的反应容器,达到平衡时有50%的CO转化为CO2。在tl时保持温度不变,再充入1 mol H2O(g),请在图中画出tl时刻后H2的体积分数变化趋势曲线。

③甲醇汽油可’以减少汽车尾气对环境的污染。
某化工厂用水煤气为原料合成甲醇,恒温条件下,在体积可变的密闭容器中发生反应:CO(g)+2H2(g)  CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1 mol、1 mol、1 mol,容器的体积为3L,现往容器中继续通人3 mol CO,此时v(正)??????? ? v(逆)(选填‘‘>”、“<’’或“=”),判断的理由??????? 。
CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1 mol、1 mol、1 mol,容器的体积为3L,现往容器中继续通人3 mol CO,此时v(正)??????? ? v(逆)(选填‘‘>”、“<’’或“=”),判断的理由??????? 。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、W、Z是四种常见的短周期元素,其原子
半径随原子序数变化如右图所示。已知X的一种核素的质
量数为18,中子数为10,Y和Ne原子的核外电子总数相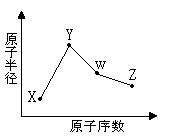
差1;W的单质是一种常见的半导体材料;Z的非金属性在
同周期主族元素中最大。
(1)W位于元素周期表中第 周期第 族
画出X的阴离子的结构示意图 。
(2)Z的氢化物和溴化氢相比,较稳定的是 (写化学式);Z的氢化物
与氟化氢相比,沸点较高的是 (写化学式)。
(3)Y的金属性与Mg的金属性相比, (写化学式)的金属性强,请用实验证明它们金属性的相对强弱: 。
(4)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物发生反应的化学反应方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com