
| A. | 乙烷和乙烯 | B. | 乙醇与乙醛 | ||
| C. | 乙酸与甲酸甲酯(HCOOCH3) | D. | 淀粉和纤维素 |
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 两种溶液中由水电离出来的c(H+)不相同 | |
| B. | 将两溶液等体积混合,则c(H+)>c(CH3COO-)═c(Cl-)>c(OH-) | |
| C. | 分别用蒸馏水稀释m倍和n倍,若两溶液pH仍相同,则m<n | |
| D. | 中和相同体积的两种酸溶液所需NaOH的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
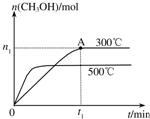 在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是( )
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是( )| A. | 该反应的△H<0 | |
| B. | 其他条件不变,升高温度反应的平衡常数增大 | |
| C. | 300℃时,0-t1min内 CH3OH的平均生成速率为$\frac{{n}_{1}}{2{t}_{1}}$mol•L-1 min-1 | |
| D. | A点的反应体系从300℃升高到500℃,达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液中滴加稀盐酸 | B. | 硫酸铁溶液中滴加硫氰化钾溶液 | ||
| C. | 碘水中滴加淀粉碘化钾溶液 | D. | 氯化铁溶液中加入还原性铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ①②⑥⑦ | C. | ③⑤⑦ | D. | ②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com