
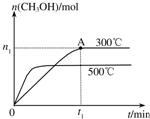
 在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是( )
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是( )| A. | 该反应的△H<0 | |
| B. | 其他条件不变,升高温度反应的平衡常数增大 | |
| C. | 300℃时,0-t1min内 CH3OH的平均生成速率为$\frac{{n}_{1}}{2{t}_{1}}$mol•L-1 min-1 | |
| D. | A点的反应体系从300℃升高到500℃,达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$减小 |
分析 A、由图象可知,温度越高,到达平衡时甲醇的物质的量越小,故升高温度平衡向逆反应移动,据此判断;
B、由图象可知,温度越高,到达平衡时甲醇的物质的量越小,升高温度平衡向逆反应移动,平衡常数减小;
C、平衡时甲醇的物质的量为n1mol,根据v=$\frac{\frac{△n}{V}}{△t}$计算v(CH3OH);
D、A点的反应体系从300℃升高到500℃,甲醇的物质的量减小,平衡向逆反应,氢气的物质的量增大,据此判断.
解答 解:A.由图象可知,温度越高,到达平衡时甲醇的物质的量越小,故升高温度平衡向逆反应移动,该反应正反应是放热反应,即△H<0,故A正确;
B.由图象可知,温度越高,到达平衡时甲醇的物质的量越小,升高温度平衡向逆反应移动,平衡常数减小,故B错误;
C.平衡时甲醇的物质的量为n1mol,v(CH3OH)=$\frac{\frac{{n}_{1}mol}{2L}}{{t}_{1}min}$=$\frac{{n}_{1}}{2{t}_{1}}$mol•L-1•min -1,故C正确;
D.A点的反应体系从300℃升高到500℃,甲醇的物质的量减小,平衡向逆反应,氢气的物质的量增大,故达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大,故D错误;
故选AC.
点评 本题考查化学平衡及其计算,题目难度中等,涉及化学平衡图象、影响平衡的因素、平衡常数影响因素、化学反应速率的计算等知识,注意掌握平衡移动原理,根据图象判断温度对平衡移动的影响,试题培养了学生的灵活应用能力.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:解答题
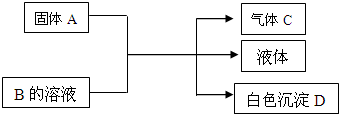 A、B、C、D均为中学化学常见的物质,它们间的反应关系如图所示.
A、B、C、D均为中学化学常见的物质,它们间的反应关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 元素性质或原子结构信息 |
| A | A元素的一种核素无中子 |
| B | B原子的次外层电子数等于最外层电子数的一半 |
| W | W的单质常温下为双原子分子,其氢化物的水溶液呈碱性 |
| G | G原子M层上有6个电子 |
| E | E元素的最高正价是+7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com