
【题目】正盐 A 能发生下图所示的反应,图中①~⑧分别代表有关反应中的一种物质(某些物质已略去),其中①、 ②、 ④、 ⑤为无色气体, ⑥为红棕色气体。(已知镁在二氧化碳气体中点燃生成碳单质和氧化镁)
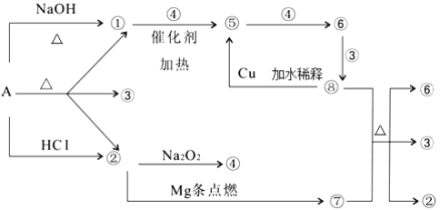
请完成下列各题:
(1)写出化学式 A__________,⑥__________,⑦_________;
(2)写出下列反应化学方程式:
⑧+⑦→②+③+⑥:_______________; ①+④→⑤:______________;
(3)⑧→⑤的离子方程式为:________________。
【答案】(1)(NH4)2CO3(1分),NO2(1分),C(1分)。
(2)4HNO3(浓)+C![]() CO2↑+4NO2↑+2H2O,(2分)
CO2↑+4NO2↑+2H2O,(2分)
4NH3+5O2![]() 4NO+6H2O。(2分)
4NO+6H2O。(2分)
(3)3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O。(2分)
【解析】
试题分析:①为A在碱性条件下生成的气体,可为NH3,②为A在酸性条件下生成的气体,可与Na2O2或Mg反应,应为CO2,则正盐A应为(NH4)2CO3,③为H2O,④为O2,⑤为NO,⑥为N02,⑧为HNO3,⑦为C,则
(1)由以上分析可知A为(NH4)2CO3,⑥为NO2,⑦为C,故答案为:(NH4)2CO3;NO2;C;
(2)⑧+⑦→②+③+⑥的反应为浓硝酸和C的反应,方程式为4HNO3(浓)+C![]() CO2↑+4N02↑+2H2O;①+④→⑤的反应为氨气的催化氧化反应,方程式为4NH3+5O2
CO2↑+4N02↑+2H2O;①+④→⑤的反应为氨气的催化氧化反应,方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(3)稀硝酸可Cu反应可生成硝酸铜和NO,反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO+4H2O。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乙醇的分子式:C2H4O B. 甲烷的分子式:CH4
C. 乙酸的结构简式:CH3CH2OH D. 乙烷的结构简式:C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知空气﹣锌电池的电极反应为锌片:Zn+2OH﹣﹣2e﹣=ZnO+H2O;碳棒:O2+2H2O+4e﹣=4OH﹣ , 据此判断,锌片是( )
A.正极,被还原
B.正极,被氧化
C.负极,被还原
D.负极,被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,反应类型与其他反应不同的是
A. 苯在浓硫酸的作用下与浓硝酸反应生成硝基苯
B. 用溴水除去乙烷中混有的乙烯
C. 乙醇与乙酸在浓硫酸的作用下生成乙酸乙酯
D. 甲烷与Cl2的混合气体在光照的条件下有油状的液滴生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含有Al2O3、Fe2O3等杂质的铬铁矿[主要成分为Fe(CrO2)2]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如下:

己知:铬铁矿在空气中与纯减煅烧生成Na2CrO4和一种红棕色固体,同时释放出CO2气体,
且 Al2O3+Na2CO3![]() 2NaAlO2+ CO2↑。请回答:
2NaAlO2+ CO2↑。请回答:
(1)在铬铁矿Fe(CrO2)2中,Cr的化合价为___________。
(2)滤渣2的成分为_____________。
(3)将滤渣1放入稀硫酸溶解后得溶液W,检验该溶液中金属离子的方法是_________。
(4)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol/L以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:
加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于________________mol/L,后续废水处理方能达到国家排放标准。
②还原法:CrO42-![]() Cr3+
Cr3+![]() Cr(OH)3。写出酸性条件下CrO42-与绿巩在溶液中反应的离子方程式:_________________________________。
Cr(OH)3。写出酸性条件下CrO42-与绿巩在溶液中反应的离子方程式:_________________________________。
(5)某高效净水剂是由K2FeO4得到的,工业上以溶液w、次氯酸钾和氢氧化钾为原料制备K2FeO4,该反应的离子方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分夹持装置已略去)进行实验。 [制取氨气的反应原理: 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O]
CaCl2+2NH3↑+2H2O]

【实验探究】
(1) 利用上述原理,实验室制取氨气应选用下图中_______________发生装置进行实验。

(2)B 装置中的干燥剂可选用______________(填“碱石灰”或“浓硫酸”)。
(3)用 5.35 g NH4Cl 固体与足量 Ca(OH)2 反应,最多可制得标准状况下氨气的体积为 _________L。( NH4Cl 的摩尔质量为 53.5 g·mol-1)
(4)气体通过 C、D 装置时,试纸颜色会发生变化的是 __________( 填“C”或“D”)。
(5)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2 滴浓盐酸,可观察到的现象是______________。
(6)F装置中倒置漏斗的作用 _____________。
(7)某同学用氨气和滴加酚酞的水做喷泉实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有________性质(填序号)。
a.还原性 b.极易溶于水 c.与水反应生成碱性物质
(8)氨气的用途很广。如可用氨气处理二氧化氮: 8NH3 + 6NO2 =7N2 + 12H2O该反应中氨气体现________( 填“氧化性”或“还原性”)。请你列举出氨气的另一种用途__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15 mL 2 mol·L1 Na2CO3溶液逐滴加入到40 mL 0.5 mol·L1 MCln盐溶液中,恰好将溶液中的Mn+ 完全沉淀为碳酸盐,则MCln中n值是
A. 4 B. 3 C. 2 D. 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1=-49.1kJ·mol-1
CH3OH(g)+H2O(g)△H1=-49.1kJ·mol-1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H2=-24.5kJ·mol-1
CH3OCH3(g)+H2O(g)△H2=-24.5kJ·mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式 。
(2)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
①已知反应2HI(g)![]() H2(g) + I2(g)的△H= + 11kJmol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为_________kJ。
H2(g) + I2(g)的△H= + 11kJmol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为_________kJ。
②Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0780 | 0.784 |
根据上述实验结果,该反应的平衡常数K的计算式为: 。上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为 (以K和k正表示)。若k正=0.0027min﹣1,在t=40min时,v正= min﹣1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

(1)用不到的仪器 (填字母)
A.烧杯 |
B.托盘天平 |
C.量筒 |
D.胶头滴管 |
E.玻璃棒
F.500mL容量瓶;
(2)实验开始前需要检验容量瓶 ;
(3)需要量取浓硫酸的体积为 ;
(4)将量取的浓硫酸沿烧杯壁慢慢注入盛有适量水的烧杯中,并不断搅拌,然后________________;
(5)将上述烧杯中的硫酸溶液转移至容量瓶时,某实验小组同学操作的示意图如下。请你指出图中错误。_______________________;
(6)某实验小组其它操作均正确,但未用蒸馏水洗涤烧杯,则其所配制溶液的浓度 ;定容时若仰视刻度线,则所配制溶液的浓度____________(填“偏大”、“偏小”或“无影响”);
(7)溶液转移及洗涤完成后,应向容量瓶中直接加水到离刻度线下__________时,改用胶头滴管加水,使溶液的凹液面正好跟刻度线水平相切。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com