
| A、由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| B、高压比常压有利于合成SO3的反应 |
| C、红棕色的NO2,加压后颜色先变深后变浅 |
| D、黄绿色的氯水光照后颜色变浅 |


科目:高中化学 来源: 题型:
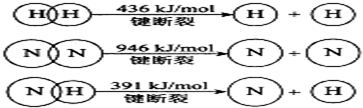
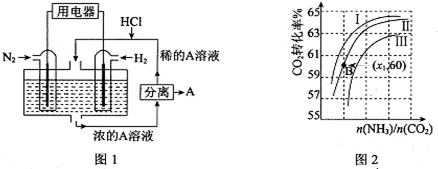
查看答案和解析>>
科目:高中化学 来源: 题型:
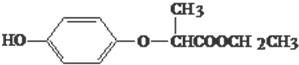
| A、HPE不能跟浓溴水反应 |
| B、1molHPE最多可以和2mol NaOH反应 |
| C、HPE在核磁共振氢谱中有6个峰 |
| D、HPE分子中有2个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 甲 池 | H2SO4(aq) | CuCl2(aq) | HCl(aq) | NaOH(aq) |
| 乙 池 | AgNO3(aq) | K2SO4(aq) | NaCl(aq) | CuSO4(aq) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
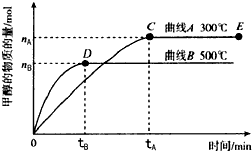
| A、平衡常数K(300℃)小于K(500℃) | ||
| B、在其他条件下不变时,压缩处于E点的体系体积,甲醇浓度增大 | ||
| C、300℃,当容器内气体密度不变时说明反应已经达到平衡 | ||
D、500℃,从反应开始到平衡,氨气的平均反应速率v(H2)=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y是地壳中含量最多的元素 |
| B、非金属性:X>Y |
| C、X、Y同主族,Y、Z同周期 |
| D、高熔点的氧化物是M |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通过煤的干馏可获得苯、甲苯等芳香烃 |
| B、在海轮外壳装上锌块,可减缓船体的腐蚀速率 |
| C、电渗析法、离子交换法法中,只有后者可以应用于海水的淡化 |
| D、我国城市推广使用清洁燃料是压缩天然气类和液化石油气类 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com