
【题目】下列电离方程式正确的是 ( )
A. NaHS 溶于水: NaHS=Na+ + HS- HS- + H2O![]() H3O+ + S2-
H3O+ + S2-
B. (NH4)2SO4溶于水: (NH4)2SO4![]() 2NH4+ + SO42-
2NH4+ + SO42-
C. 磷酸溶于水中: H3PO4![]() 3H+ + PO43-
3H+ + PO43-
D. Al(OH)3的电离: Al(OH)3![]() Al3+ + 3OH-
Al3+ + 3OH-
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是
A. KSCN B. BaCl2 C. NaOH D. HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率为( )
4NO(g)+6H2O(g),在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率为( )
A. v(O2)=0.01 mol/(L·s) B. v(NO)=0.008 mol/(L·s)
C. v(H2O)=0.003 mol/(L·s) D. v(NH3)=0.004 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验Ⅰ~Ⅳ的说法正确的是
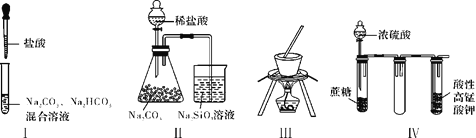
A. 实验Ⅰ:逐滴滴加盐酸时,试管中立即产生大量气泡
B. 实验Ⅱ:通过实验现象可比较氯、碳、硅三种元素的非金属性强弱
C. 实验Ⅲ:本装置可以用于从饱和食盐水制取NaCl晶体
D. 实验Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关除杂质(括号中为杂质)的操作中,正确的是
A. 甲烷(乙烯):通入足量酸性高锰酸钾溶液洗气
B. 硝基苯(硝酸):多次加入氢氧化钠溶液,充分振荡,分液,弃水层
C. 溴苯(漠):加水振荡,分液,弃水层
D. 乙酸乙酯(乙酸):加饱和碳酸钠溶液,蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是一种高效、速效抗疟药,是中医药献给世界的一份礼物。屠呦呦因在发现、研究青蒿素方面做出的杰出贡献而获得2015年诺贝尔医学奖。青蒿素分子结构如下图,下列说法中正确的是

A.青蒿素能与热的NaOH溶液反应
B.青蒿素的分子式为C15H21O5
C.青蒿素分子结构中只含有极性键
D.青蒿素能使酸性KMnO4溶液、溴的CCl4溶液分别褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一,铁及其化合物在现代社会各个领域仍有广泛的应用。
I.氧化物—Fe2O3:用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)制取高纯铁红,实验室常用萃取剂X(甲基异丁基甲酮)萃取法制取高纯铁红的主要实验步骤如下:

已知:HCl(浓) + FeCl3![]() HFeCl4 。试回答下列问题:
HFeCl4 。试回答下列问题:
(1)用萃取剂X萃取,该步骤中:
① Ca2+、Mn2+、Cu2+等杂质离子主要在__________(填“水”或“有机”)相。
② 若实验时共用萃取剂X 150mL,萃取率最高的方法是__________(填字母)。
a.一次性萃取,150mL b.分2次萃取,每次75mL c.分3次萃取,每次50mL
(2)用高纯水反萃取,萃取后水相中铁的存在形式是________________(写化学式);反萃取能发生的原因是___________________。
(3)所得草酸铁沉淀需用冰水洗涤,其目的一是洗去沉淀表面吸附的杂质离子,二是________________。
(4)测定产品中铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标准K2Cr2O7溶液滴定,已知铬的还原产物为Cr3+,写出该滴定反应的离子方程式 ___________________。
II.含氧酸盐—铁酸铜(CuFe2O4)是很有前景的热化学分解水制氢的材料,CuFe2O4在制氢过程中可以循环使用。在热化学循环分解水制氢的过程中,铁酸铜(CuFe2O4)先要煅烧成氧缺位体(CuFe2O4-a),氧缺位值(a)越大,活性越高,制氢越容易。
(5)根据以上提示,写出氧缺位体与水常温下反应制氢的化学方程式____________。
(6)课外小组将铁酸铜样品在N2的气氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,则氧缺位值(a)=__________。(结果保留小数点后2位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是
Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是
A. 容器内的总压强不随时间变化
B. 断裂4molH—O键的同时,断裂4molH—H键
C. 混合气体的平均相对分子质量不变
D. 反应不再进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com