
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率为( )
4NO(g)+6H2O(g),在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率为( )
A. v(O2)=0.01 mol/(L·s) B. v(NO)=0.008 mol/(L·s)
C. v(H2O)=0.003 mol/(L·s) D. v(NH3)=0.004 mol/(L·s)
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】已知在稀溶液中:1mol弱酸HX与1molNaOH反应的反应热△H=-12.1kJ/mol;HCl与NaOH反应的中和热△H=-55.6kJ/mol。则HX在稀溶液中的电离热△H等于(单位:kJ/mol)
A. +43.5 B. -43.5 C. -67.7 D. +67.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp (CaC2O4)=4.010-9,若在c(Ca2+)=0.020mol·L-1的溶液生成CaC2O4沉淀,溶液中的c(C2O42-)最小应为( )
A. 4.010-9mol·L-1 B. 2.010-7mol·L-1 C. 2.010-9mol·L-1 D. 8.010-11mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年11月5 日,长征三号乙运载火箭将两颗北斗三号全球导航卫星送入太空轨道。下列有关说法正确的是
A. 火箭燃料中的四氧化二氮属于化石燃料 B. 火箭燃料燃烧时将化学能转化为热能
C. 火箭箭体采用铝合金是为了美观耐用 D. 卫星计算机芯片使用高纯度的二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】U、V、W、X、Y、Z是原子序数依次增大的短周期元素。已知:
①WU4++XU-==WU3+U2X,各种反应物和生成物的电子总数都与Y+相等;
②Z的单质在X2中燃烧的产物可使品红溶液褪色;
③V的单质在X2中燃烧可生成VX和VX2两种气体;
④Y的单质是一种金属,该金属与X2反应可生成Y2X和Y2X2两种固体。
请回答下列问题:
(1)写出Y2X2与水反应的化学方程式:________________。
(2)V、W、X形成的10电子氢化物中,沸点最高的是__________(写化学式)。
(3)U2X2与FeSO4按物质的量之比1:2溶于稀硫酸中,反应的离子方程式为__________。
(4)常温下,向pH=11的Y2VX3溶液中加入过量石灰乳,过滤后所得溶液pH=13,则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是_________。
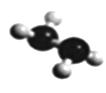
(5)已知由U、W两种元素组成的共价化合物联氨的球棍模型如图所示,则联氨分子的电子式为____________。联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为_______(已知:N2H4+H+==N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与过量硫酸形成的酸式盐的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是 ( )
A. NaHS 溶于水: NaHS=Na+ + HS- HS- + H2O![]() H3O+ + S2-
H3O+ + S2-
B. (NH4)2SO4溶于水: (NH4)2SO4![]() 2NH4+ + SO42-
2NH4+ + SO42-
C. 磷酸溶于水中: H3PO4![]() 3H+ + PO43-
3H+ + PO43-
D. Al(OH)3的电离: Al(OH)3![]() Al3+ + 3OH-
Al3+ + 3OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应aA(s)+bB(g ![]() cC(g)+dD(g)达到平衡时,B%跟压强P和温度T(T2>T1)之间的关系如图所示(填“增大”“减小”“吸”“放”“正”“逆”)
cC(g)+dD(g)达到平衡时,B%跟压强P和温度T(T2>T1)之间的关系如图所示(填“增大”“减小”“吸”“放”“正”“逆”)

①当压强不变时,升高温度,B%变______,其反应为_______热反应。
②当温度不变,增大压强时,B%变_______,平衡向______方向移动,方程式中系数间关系是_____。
③当温度不变,增大压强时,若B%不变,则方程式中系数关系是____ _。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌及其化合物的性质与铝及其化合物的性质相似。现向ZnCl2溶液中逐渐滴加NaOH溶液,溶液的PH与某些离子的浓度关系如图(横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数;假设Zn2+的浓度为10-5mol/L时,已沉淀完全)。则下列说法不正确的是

A. 某废液中含Zn2+,沉淀对Zn2+以控制溶液pH的范围是(8,12 ) ,
B. 往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:Zn2++4OH-=[Zn(OH)4]2-
C. 向1L 0.01mol/LZnCl2溶液中逐渐滴加NaOH溶液,当PH>6时Zn2+开始沉淀
D. 向1L 0.01mol/LZnCl2溶液中逐渐滴加NaOH溶液至PH=7,此时溶液中Zn2+的浓度为10-3mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com