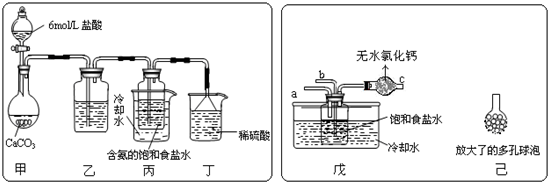
草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾.现从草木灰中提取钾盐,并用实验检验其中的 CO32-、SO42-、和 Cl-
(1)从草木灰中提取钾盐的实验操作顺序如下:①称取样品,②溶解沉降,③______,④______,⑤冷却结晶.
(2)用托盘天平称量样品时,若指针偏向右边,则表示______(填选项的标号).
A、左盘重,样品轻 B、左盘轻,砝码重
C、右盘重,砝码轻 D、右盘轻,样品重
(3)在进行②、③、④操作时,都要用到玻璃棒,其作用分别是:
②______;③______;④______
(4)将制得的少量晶体放入试管,加热蒸馏水溶解并把溶液分成三份,分装在3支试管里.
①在第一支试管里加入稀盐酸,可观察有______生成,证明溶液中有______离子.
②在第二支试管里加入足量盐酸后,再加入 BaCl2 溶液,可观察到有______ 生成,证明溶液中有______离子.
③在第三支试管里加入足量稀硝酸后,再加入 AgNO3 溶液,可观察到有______生成,证明溶液中有______离子.
解:(1)草木灰中的钾盐可以溶于水中形成溶液,然后利用过滤的方法可以获得钾盐的水溶液,将所得的水溶液蒸发结晶可以获得氯化钾的固体,
故答案为:过滤,取滤液;蒸发滤液;
(2)用托盘天平称量样品时,若指针偏向右边,则表示左盘轻、砝码重,故答案为:B;
(3)在溶解固体时,使用玻璃棒可以加速溶解,在过滤操作中,可以用玻璃棒来引流,在蒸发结晶操作中,用玻璃棒来搅拌,使得受热均匀(防止液体飞溅),
故答案为:加速溶解;引流;受热均匀(防止液体飞溅);
(4))①碳酸根离子能和盐酸反应生成二氧化碳,向溶液中加入稀盐酸后有气泡生成说明有碳酸根离子,故答案为:气泡;CO32-;
②向原溶液中滴加盐酸酸化的氯化钡溶液,排除了其它阴离子的干扰,如果产生白色沉淀,就说明溶液中有硫酸根离子,故答案为:白色沉淀;SO42-;
③向原溶液中滴加足量稀硝酸后,排除了其它离子的干扰,再加入 AgNO3 溶液,产生白色沉淀,说明溶液中有氯离子,故答案为:白色沉淀;Cl-.
分析:(1)草木灰中的钾盐可以溶于水中形成溶液,可以利用过滤的方法来获得钾盐的水溶液,加热蒸发可得到晶体;
(2)根据天平平衡的原理,把样品放在右盘,砝码放在左盘,若指针偏向右边,则右边重;
(3)玻璃棒可用于搅拌、引流等作用;
(4)碳酸根离子和盐酸反应产生气体,硫酸根离子和盐酸酸化钡离子反应生成白色沉淀;氯离子和硝酸酸化的银离子反应生成白色沉淀.
点评:本题考查离子的检验,分离提纯题等问题,题目难度不大,注意基础知识的积累.



 名校课堂系列答案
名校课堂系列答案 3HNCO;8HNCO+6NO2
3HNCO;8HNCO+6NO2 7N2+8CO2+4H2O.
7N2+8CO2+4H2O. 乙
乙 丙.下列有关物质的推断不正确的是
丙.下列有关物质的推断不正确的是 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O