
【题目】下列关于有机物说法不正确的是( )
A.![]() 的名称为2-甲基-1,3-二丁烯
的名称为2-甲基-1,3-二丁烯
B.含8个碳原子的有机物,每个分子中可能形成8个C—C单键
C.![]() 属于芳香烃且属于苯的同系物
属于芳香烃且属于苯的同系物
D.沸点比较:乙二醇>乙醇>乙烷
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】电解装置如图所示:

Ⅰ.当用惰性电极电解时,c为____________极, d极的电极反应_________,电解总反应的化学方程____________________
Ⅱ.(1)若用此装置进行铁上镀铜则c为__________(填铁或铜),电解液浓度_____________(增大,减小或不变)
(2)电镀一段时间后对电极进行称量发现两极质量差为16克,则电路中转移的电子___________mol.
Ⅲ.若用此装置进行粗铜的电解精炼。则要求粗铜板是图中电极________(填图中的字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色;J分子内有两个互为对位的取代基.在一定条件下有如下的转化关系:(无机物略去)
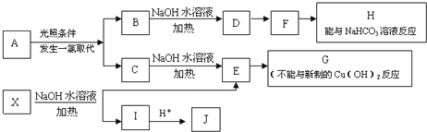
(1)属于芳香烃类的A的同分异构体中,其沸点的大小关系为______;(不包括A,用结构简式表示)
(2)J中所含的含氧官能团的名称为______;
(3)E与H反应的化学方程式是________;反应类型是_______;
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物I,以I为单体合成的高分子化合物的名称是______;
(5)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式_______;
①与FeCl3溶液作用显紫色
②与新制Cu(OH)2悬浊液作用产生红色沉淀
③苯环上的一卤代物有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将不同物质的量的M(g)和N(g)分别通入体积为2L的恒容密闭容器中,进行反应M(g)+N(g)![]() P(g)+Q(g),得到如下两组数据:
P(g)+Q(g),得到如下两组数据:

下列说法正确的是( )
A.将实验2的体积压缩为1L,c(Q)为0.4molL-1
B.温度升高,该反应的平衡常数增大
C.选择合适的催化剂可降低该反应的活化能,提高M的转化率
D.实验1中M的化学反应速率为0.32molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磺酰氯(SO2C12)主要用作氯化剂或氯磺化剂,熔、沸点分别为-54.1°C和69°C,在空气中遇水蒸气发生剧烈反应产生大量白雾。某实验室用干燥的SO2和Cl2 通入如图装置乙(省略夹持装置)制取磺酰氯。回答下列问题:

(1)组合装置甲的作用是制取干燥纯净的氯气,仪器连接的正确顺序是e→____,____→____,____→g。
(2)为提高实验中磺酰氯的产率,实验中可采取的措施有_______(只答一条即可)
(3)实验时在导管口f接一装置,该装置为________(填标号)。

(4)SO2C12遇水蒸气反应的化学方程式为________。
(5)反应结束后,安装好蒸馏装置,把三颈烧瓶中的物质和沸石加入到蒸镏烧瓶中,接下来的操作是先_______,然后_______,弃去前馏分,收集69℃的馏分,得到磺酰氯粗品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:2CO(g)+SO2(g)![]() 2CO2(g)+S(l) ΔH
2CO2(g)+S(l) ΔH
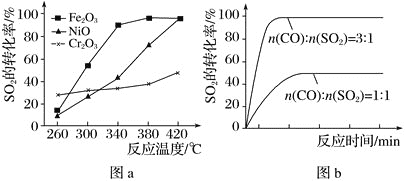
(1)已知:2CO(g)+O2(g)=2CO2(g) ΔH1=-566kJmol-1;S(l)+O2(g)=SO2(g) ΔH2=-296 kJmol-1,则反应热ΔH=___kJmol-1。
(2)其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图a所示。260℃时___(填“Fe2O3”、“NiO”或“Cr2O3”)作催化剂反应速率最快。Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑价格因素,选择Fe2O3的主要优点是___。
(3)科研小组在380℃、Fe2O3作催化剂时,研究了不同投料比[n(CO):n(SO2)]对SO2转化率的影响,结果如图b所示。请分析当n(CO):n(SO2)=1:1时,SO2转化率接近50%的原因___。
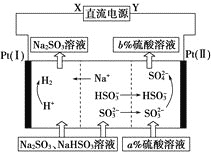
(4)工业上还可用Na2SO3溶液吸收烟气中的SO2:Na2SO3+SO2+H2O=2NaHSO3。某温度下用1.0molL-1Na2SO3溶液吸收纯净的SO2,当溶液中c(SO32-)降至0.2molL-1时,吸收能力显著下降,应更换吸收剂。此时溶液中c(HSO3-)约为___molL-1,溶液的pH=___。(已知该温度下亚硫酸的平衡常数Ka1=1.75×10-2,Ka2=1.25×10-7)
(5)用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示。请写出该电解过程中,阴极区发生反应的方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,二氧化碳(CO2)的排放量也要大幅减少。
(1)在恒温,容积为1L恒容容器中,硫可以发生如下转化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6kJmol-1),请回答下列问题:
2SO3(g) ΔH=-196.6kJmol-1),请回答下列问题:
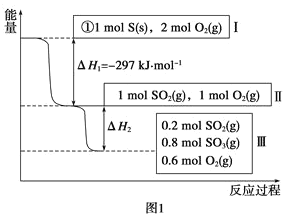
写出能表示硫的燃烧热的热化学方程式:___。
②ΔH2=___kJmol-1。
③在相同条件下,充入1molSO3和0.5mol的O2,则达到平衡时SO3的转化率为___;此时该反应___(填“放出”或“吸收”)___kJ的能量。
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
①CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJmol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3min到9min,v(H2)=___molL-1min-1。
CH3OH(g)+H2O(g) ΔH=-49.0kJmol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3min到9min,v(H2)=___molL-1min-1。

②能说明上述反应达到平衡状态的是___(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1:1
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3molH2,同时生成1molH2O
D.CO2的体积分数在混合气体中保持不变
③为加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有___(填编号)。
A.升高温度 B.缩小容器体积 C.再充入水蒸气 D.使用合适的催化剂
(3)工业上,CH3OH也可由CO和H2合成。参考下表中合成反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数。下列说法正确的是___。
CH3OH(g)的平衡常数。下列说法正确的是___。
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该反应正反是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应ΔS<0
C.在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒电池以惰性材料做电解,在电解质溶液中发生的总反应式为:VO2+(蓝色)+H2O+V3+(紫色)![]() VO2+(黄色)+ V2+(绿色)+2H+,下列说法正确的是( )
VO2+(黄色)+ V2+(绿色)+2H+,下列说法正确的是( )
A.当电池放电时,VO2+离子被氧化
B.放电过程中,正极附近溶液的pH变大
C.充电时,阳极附近溶液由绿色逐渐变为紫色
D.放电时,负极反应为:VO2+ +2H+ +2e- =VO2+ +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关.
(1)下列生活用品中,其主要材料属于天然纤维的是_________(填字母序号);
A.塑料保鲜薄 B.橡胶手套 C.棉布围裙
(2)我们常用的洗涤剂清洗餐具上的油污,这是因为洗涤剂具有_________的功能;
(3)食用水果、蔬菜主要补充人体所需的_________;
(4)国家禁止在面粉中添加增白剂过氧化钙CaO2,过氧化钙中氧元素的化合价为_______;
(5)农业上降低土壤酸性的是_________(填化学式);
(6)生活中要用到大量的钢铁,写出赤铁矿(主要成分Fe2O3)冶炼成铁的化学方程式______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com