
【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,二氧化碳(CO2)的排放量也要大幅减少。
(1)在恒温,容积为1L恒容容器中,硫可以发生如下转化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6kJmol-1),请回答下列问题:
2SO3(g) ΔH=-196.6kJmol-1),请回答下列问题:
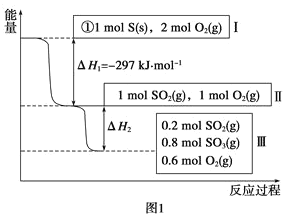
写出能表示硫的燃烧热的热化学方程式:___。
②ΔH2=___kJmol-1。
③在相同条件下,充入1molSO3和0.5mol的O2,则达到平衡时SO3的转化率为___;此时该反应___(填“放出”或“吸收”)___kJ的能量。
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
①CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJmol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3min到9min,v(H2)=___molL-1min-1。
CH3OH(g)+H2O(g) ΔH=-49.0kJmol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3min到9min,v(H2)=___molL-1min-1。

②能说明上述反应达到平衡状态的是___(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1:1
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3molH2,同时生成1molH2O
D.CO2的体积分数在混合气体中保持不变
③为加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有___(填编号)。
A.升高温度 B.缩小容器体积 C.再充入水蒸气 D.使用合适的催化剂
(3)工业上,CH3OH也可由CO和H2合成。参考下表中合成反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数。下列说法正确的是___。
CH3OH(g)的平衡常数。下列说法正确的是___。
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该反应正反是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应ΔS<0
C.在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
【答案】S(s)+O2(g)=SO2(g) △H=-297kJmol-1 -78.64 20% 吸收 19.66 0.125 D B AC
【解析】
(1)①1mol可燃物完全燃烧生成稳定氧化物放出的热量为燃烧热,据此结合图象分析;
②根据热化学方程式:2SO2(g)+O2(g)2SO3(g)△H=-196.6KJmol-1计算;
③假设1molSO3和0.5molO2完全转化为SO2和O2,与原来的初始量相同,所以两次平衡是等效平衡,即平衡时SO2为0.2mol,SO3为0.8mol;当反应逆向进行时反应热大小不变,符号相反,根据物质的量之比等于热量比求算;
(2)①根据v=![]() 计算出v(CH3OH),然后根据速率之比等于化学计量数之比求出v(H2);
计算出v(CH3OH),然后根据速率之比等于化学计量数之比求出v(H2);
②根据平衡状态的判断标准:正逆反应速率相等;各组分浓度保持不变及由此衍生的其它物理量进行分析。
③将上述平衡体系的温度升高至700℃,平衡常数K=5.01,温度升高K值减少,所以正反应是放热反应,
A.升高温度,化学反应速率,平衡逆向移动,使体系中气体的物质的量增加;
B.缩小容器的容积,反应物浓度变大,反应速率加快,平衡正向移动,气体的物质的量减少;
C.再充入CO2气体,化学反应速率,平衡正向移动,物质的量增加;
D.使用合适的催化剂,化学反应速率加快,平衡不移动,物质的量不变;
(3)A.由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,升高温度平衡向吸热反应移动;
B.根据△G=△H-T△S判断,△G>0,反应不能自发进行;△G<0,反应自发进行;
C.利用三段式计算出平衡时平衡混合物各组分的浓度,代入平衡常数的表达式计算;
D.由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,不利用原料气转化。
(1)①燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,所以,硫的物质的量为1mol;由图1可知1molS(s)完全燃烧生成SO2放出的热量为297KJ,所以硫的燃烧热的热化学方程式为:S(s)+O2(g)=SO2(g) △H=-297kJmol-1;
故答案为:S(s)+O2(g)=SO2(g) △H=-297kJmol-1;
②由图1可知,参加反应的n(SO2)=1mol0.2mol=0.8mol,根据热化学方程式:2SO2(g)+O2(g)2SO3(g)△H=-196.6KJmol-1;可知,△H2=0.4△H=0.4×(196.6 Jmol-1)=78.64 Jmol-1;
故答案为:78.64;
③假设1molSO3和0.5molO2完全转化为SO2和O2,则与原来的初始量相同,所以两次平衡是等效平衡,即平衡时SO2为0.2mol,SO3为0.8mol;所以SO3转化了0.2mol,则达到平衡时SO3的转化率为0.2mol1mol×100%=20%;已知2SO2(g)+O2(g)2SO3(g)△H=-196.6KJmol-1,当反应逆向进行时反应热大小不变,符号相反,所以SO3转化SO2时反应吸热,热量为196.6KJ×![]() =19.66KJ;
=19.66KJ;
故答案为:20%;吸收;19.66;
(2)①由图象可知:v(CH3OH)= ![]() =
=![]() mol/(Lmin),v(H2)=3v(CH3OH)=0.125mol/(Lmin);
mol/(Lmin),v(H2)=3v(CH3OH)=0.125mol/(Lmin);
故答案为:0.125mol/(Lmin);
②A.反应中CO2与CH3OH的物质的量浓度之比为1:1时,没有达到平衡状态,故A错误;
B.由于气体的总质量不变,容器的体积不变,则无论是否达到平衡状态,气体的密度都不变,故B错误;
C.化学反应速率之比等于化学计量数之比,无论是否达到平衡状态,都存在单位时间内每消耗3molH2,同时生成1molH2O,故C错误;
D.CO2的体积分数在混合气体中保持不变,说明达到平衡状态,故D正确;
故选:D。
③将上述平衡体系的温度升高至700℃,平衡常数K=5.01,温度升高K值减少,所以正反应是放热反应,所以△H<0,
A.升高温度,化学反应速率,平衡逆向移动,使体系中气体的物质的量增加,故A错误;
B.缩小容器的容积,反应物浓度变大,反应速率加快,平衡正向移动,气体的物质的量减少,故B正确;
C.再充入CO2气体,化学反应速率,平衡正向移动,物质的量增加,故C错误;
D.使用合适的催化剂,化学反应速率加快,平衡不移动,物质的量不变,故D错误;
故选:B;
(3)A.由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应,故A正确;
B.反应为放热反应△H<0,△G=△HT△S<0,反应自发进行,△S<0,低温下,反应也可以自发进行,故B错误;
C.对于可逆反应: CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
开始(mol/L):0.1 0.20 0
变化(mol/L):0.05 0.1 0.05
平衡(mol/L):0.05 0.1 0.05
所以平衡常数k=![]() =100,故C正确;
=100,故C正确;
D.增大压强,平衡向正反应移动,有利于原料气转化。由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,故升高不利用原料气转化,采取250℃温度,考虑反应速率与催化剂的活性,故D错误;
故选:AC。


科目:高中化学 来源: 题型:
【题目】在某温度时将 ![]() 氨水滴入
氨水滴入 ![]() 盐酸中,溶液 pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
盐酸中,溶液 pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是

A.![]()
B.水的电离程度:![]()
C.c点:![]()
D.d点:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZulemaBoqas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )

A.负极区是强碱性环境
B.每消耗2.24L(标况)的空气,有0.4mol电子
C.负极反应为:CH3COO-+2H2O-8e- =2CO2↑+7H+
D.Y为阴离子选择性交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物说法不正确的是( )
A.![]() 的名称为2-甲基-1,3-二丁烯
的名称为2-甲基-1,3-二丁烯
B.含8个碳原子的有机物,每个分子中可能形成8个C—C单键
C.![]() 属于芳香烃且属于苯的同系物
属于芳香烃且属于苯的同系物
D.沸点比较:乙二醇>乙醇>乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将体积均为5 mL的甲、乙、丙三种液体依次沿试管壁缓缓滴入试管中(勿振荡),出现如图所示的实验现象,则甲、乙、丙的组合可能是( )
![]()
选项 | A | B | C | D |
甲 | 1,2二溴乙烷 | 溴苯 | 水 | 乙醇 |
乙 | 水 | 液溴 | 大豆油 | 乙酸 |
丙 | 苯 | 乙醇 | 溴水 | 乙酸乙酯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列三种有机物,实现它们之间相互转化所选试剂(均足量)正确的是( )
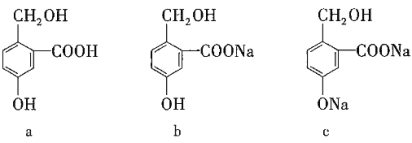
选项 | a转化为b | a转化为c | c转化为b |
A | NaOH | Na | CO2 |
B | Na2CO3 | NaOH | HCl |
C | NaHCO3 | NaOH | CO2 |
D | NaHCO3 | NaCl | HCl |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的化工原料,以丙烯为原料合成有机玻璃和油墨材料DAP-A树脂的流程如下:

回答问题:
(1)写出下列物质可能的结构简式:B___________________,F________________________。
(2)写出反应类型:反应②___________________;反应③____________________________。
(3)1 mol DAP-A树脂在一定条件下与H2发生加成反应,最多消耗H2_______________mol。
(4)写出反应①的化学方程式_____________________________________________________。
(5)写出G在一定条件下与乙二醇发生反应生成一种高分子化合物的化学方程式为_______。
(6)E的同分异构体中,属于酯类的链状有机物有HCOOCH2CH=CH2、HCOOCH=CHCH3、___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH↓+NH4+
B.向NaHCO3溶液中加入醋酸:HCO3-+CH3COOH =CO2↑+H2O+CH3COO-
C.乙醛与新制的碱性氢氧化铜悬浊液加热反应:CH3CHO+2Cu(OH)2+2OH-![]() CH3COO-+2CuO↓+3H2O
CH3COO-+2CuO↓+3H2O
D.苯酚浊液中滴加碳酸钠溶液:2![]() +Na2CO3 =2
+Na2CO3 =2![]() +CO2 +H2O
+CO2 +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液逐滴加入0.2mol·L1的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示。下列判断正确的是( )

A. 原NaOH溶液的浓度为0.1mol·L1
B. 通入CO2的体积为448mL
C. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=2∶1
D. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com