
【题目】下列离子方程式正确的是
A.AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH↓+NH4+
B.向NaHCO3溶液中加入醋酸:HCO3-+CH3COOH =CO2↑+H2O+CH3COO-
C.乙醛与新制的碱性氢氧化铜悬浊液加热反应:CH3CHO+2Cu(OH)2+2OH-![]() CH3COO-+2CuO↓+3H2O
CH3COO-+2CuO↓+3H2O
D.苯酚浊液中滴加碳酸钠溶液:2![]() +Na2CO3 =2
+Na2CO3 =2![]() +CO2 +H2O
+CO2 +H2O
【答案】B
【解析】
A.向AgNO3溶液中加入过量的氨水反应生成银氨溶液,反应的离子反应为Ag++2NH3H2O═[Ag(NH3)2]++2H2O,故A错误;
B.碳酸氢钠溶液中加入醋酸,该反应的离子方程式为:HCO3-+CH3COOH→CH3COO-+H2O+CO2↑,故B正确;
C.乙醛与碱性氢氧化铜悬浊液混合后加热至沸腾生成氧化亚铜沉淀,离子方程式:CH3CHO+2Cu(OH)2+OH- ![]() Cu2O↓+CH3COO-+3H2O,故C错误;
Cu2O↓+CH3COO-+3H2O,故C错误;
D.向苯酚浊液中滴加Na2CO3溶液,二者反应生成苯酚钠和碳酸氢钠,离子方程式:C6H5OH+CO32-→C6H5O-+HCO3-,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.MnO2与浓盐酸反应制Cl2:MnO2+4HCl![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B.明矾溶于水产生Al(OH)3胶体:Al3++3H2O =Al(OH)3↓+3H+
C.Na2O2溶于水产生O2:Na2O2+H2O =2Na++2OH-+O2↑
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-= CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.标准状况下,将22.4 LHCl溶于1 L水,可配成1 mol/L的稀盐酸
B.把200 mL3 mol/L的MgCl2溶液跟100 mL3 mol/L的KCl溶液混合后,溶液中的Cl-的物质的量浓度仍然是3 mol/L
C.用胆矾(CuSO45H2O)配制500 mL5 mol/L的CuSO4溶液,需胆矾40 g
D.将0.1 mol NaCl配成100 mL溶液,从中取出10 mL,所取出溶液的物质的量浓度为1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
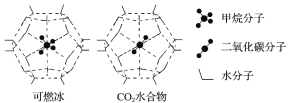
【题目】(1)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/kJ·mol-1 |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
①“可燃冰”中分子间存在的两种作用力是_____________________________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是_____。
(2) H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅在氧气中完全燃烧的化学方程式为:Si+O2![]() SiO2,1 mol Si完全燃烧生成SiO2放出992kJ的热量。已知断裂1mol Si-Si键、1mol O=O键和1mol Si-O键吸收的能量分别为176kJ、496kJ、460kJ。晶体结构知识告诉我们,1mol SiO2中含有4mol Si-O键,则1molSi中含有Si-Si键的物质的量为( )
SiO2,1 mol Si完全燃烧生成SiO2放出992kJ的热量。已知断裂1mol Si-Si键、1mol O=O键和1mol Si-O键吸收的能量分别为176kJ、496kJ、460kJ。晶体结构知识告诉我们,1mol SiO2中含有4mol Si-O键,则1molSi中含有Si-Si键的物质的量为( )
A. 1mol B. 2mol C. 3mol D. 4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用碱式溴化镁废渣[主要成分为Mg(OH)Br,还含有少量有机溶剂及高分子化合物]生产C2H5Br(不溶于水,密度为1.46g/cm3)和MgCl2·6H2O,既可减少污染又可得化工原料,有关工艺流程如图所示:

回答下列问题:
(1)碱式溴化镁溶于盐酸时,1molMg(OH)Br消耗0.5mol/L的盐酸体积为_______________。
(2)分离Ⅰ操作为_______________(操作名称);分离Ⅱ操作时所需的玻璃仪器为_______________。
(3)提溴时,溶液预热至60℃时开始通入氯气,一段时间后,溶液的温度会自然升高到100℃,说明提溴反应为_______________(填“放热”或“吸热”)反应。提溴废液需减压、蒸发、浓缩的目的是_______________。
(4)在浓硫酸催化下,合成溴乙烷粗品的化学方程式为_______________;
(5)精制溴乙烷的步骤为水洗、Na2SO3溶液洗涤、水洗及干燥,其中Na2SO3溶液洗涤的目的是_______________。
(6)用惰性电极在一定条件下电解MgCl2溶液可制取催熟剂氯酸镁,该电解反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在密闭容器内进行着某一反应,X 气体、Y 气体的物质的量随反应时间变化的曲线如右图。下列叙述中正确的是
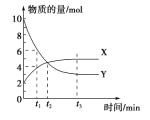
A. 反应的化学方程式为5Y![]() X B. t1 时,Y 的浓度是 X 浓度的1.5 倍
X B. t1 时,Y 的浓度是 X 浓度的1.5 倍
C. t2 时,正、逆反应速率相等 D. t3 时,逆反应速率大于正反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量是( )
A. 1.4gB. 2.2gC. 4.4gD. 在2.2g和4.4g之间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com