
【题目】一定温度下在密闭容器内进行着某一反应,X 气体、Y 气体的物质的量随反应时间变化的曲线如右图。下列叙述中正确的是
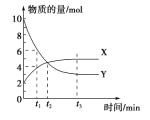
A. 反应的化学方程式为5Y![]() X B. t1 时,Y 的浓度是 X 浓度的1.5 倍
X B. t1 时,Y 的浓度是 X 浓度的1.5 倍
C. t2 时,正、逆反应速率相等 D. t3 时,逆反应速率大于正反应速率
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】实验室从含碘废液![]() 除
除![]() 外,含有
外,含有![]() 、
、![]() 、
、![]() 等
等![]() 中回收碘,其实验过程如图1:
中回收碘,其实验过程如图1:
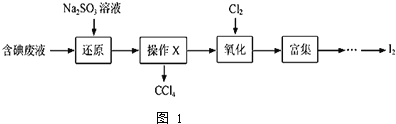
![]() 向含碘废液中加入稍过量的
向含碘废液中加入稍过量的![]() 溶液,将废液中的
溶液,将废液中的![]() 还原为
还原为![]() ,其离子方程式为 ______ ;该操作将
,其离子方程式为 ______ ;该操作将![]() 还原为
还原为![]() 的目的是 ______ .
的目的是 ______ .
![]() 操作X的名称为 ______ .
操作X的名称为 ______ .
![]() 氧化时,在三颈瓶中将含
氧化时,在三颈瓶中将含![]() 的水溶液用盐酸调至pH约为2,缓慢通入
的水溶液用盐酸调至pH约为2,缓慢通入![]() ,在
,在![]() 左右反应
左右反应![]() 实验装置如图2所示
实验装置如图2所示![]() 实验控制在较低温度下进行的原因是 ______ ;锥形瓶里盛放的溶液为 ______ .
实验控制在较低温度下进行的原因是 ______ ;锥形瓶里盛放的溶液为 ______ .
![]() 利用如图3所示装置
利用如图3所示装置![]() 电极均为惰性电极
电极均为惰性电极![]() 也可吸收
也可吸收![]() ,并用阴极排出的溶液吸收
,并用阴极排出的溶液吸收![]() .
.
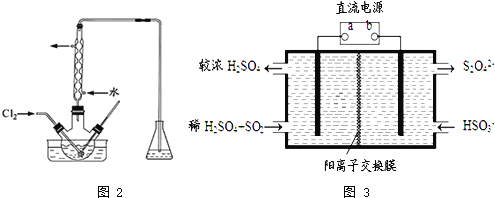
![]() 为电源的 ______
为电源的 ______ ![]() 填“正极”或“负极”
填“正极”或“负极”![]() ,阳极的电极反应式为 ______ .
,阳极的电极反应式为 ______ .
![]() 在碱性条件下,用阴极排出的溶液吸收
在碱性条件下,用阴极排出的溶液吸收![]() ,使其转化为无害气体,同时有
,使其转化为无害气体,同时有![]() 生成.该反应中氧化剂与还原剂的物质的量之比为 ______ .
生成.该反应中氧化剂与还原剂的物质的量之比为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH↓+NH4+
B.向NaHCO3溶液中加入醋酸:HCO3-+CH3COOH =CO2↑+H2O+CH3COO-
C.乙醛与新制的碱性氢氧化铜悬浊液加热反应:CH3CHO+2Cu(OH)2+2OH-![]() CH3COO-+2CuO↓+3H2O
CH3COO-+2CuO↓+3H2O
D.苯酚浊液中滴加碳酸钠溶液:2![]() +Na2CO3 =2
+Na2CO3 =2![]() +CO2 +H2O
+CO2 +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A,由C、H、O三种元素组成,在一定条件下,由A可以转化为有机物B、C、D、E;C又可以转化为B、D。它们的转化关系如下:已知D的蒸气密度是氢气的22倍,并可以发生银镜反应。
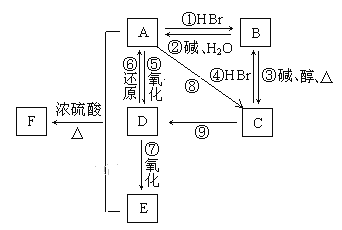
(1)写出A、D、的结构简式和所含官能团名称A_______、________,D__________、___________
(2)写出反应⑤的化学方程式___________________________________;
(3)从组成上分析反应⑨是___________(填反应类型)。
(4)F的同分异构体中能与NaOH溶液发生反应的共_______种(包含F),写出其中一种与NaOH溶液反应的化学方程式______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沼气是一种能源,它的主要成分是CH4,0.5molCH4完全燃烧生成CO2和H2O时,放出445kJ热量,则下列热化学方程式中正确的是()
A.2CH4(g)+4O2(g)=2CO2(g)+4H2O(l)ΔH=+890kJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=+890kJ·mol-1
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890kJ·mol-1
D.![]() CH4(g)+O2(g)=
CH4(g)+O2(g)=![]() CO2(g)+H2O(l)ΔH=-890kJ·mol-1
CO2(g)+H2O(l)ΔH=-890kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Cl﹣、SO42﹣、CO32﹣、NH4+、Fe3+、Fe2+、Al3+ 和Na+.某同学为了确认其成分,取部分试液,设计并完成了如下实验:由此可知原溶液中
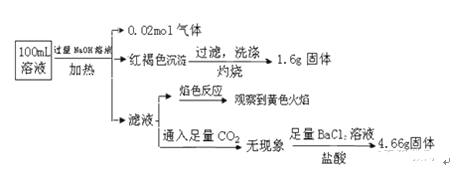
A. 溶液中至少有4种离子存在,其中Cl﹣一定存在,且c(Cl﹣)≥0.2 molL﹣1
B. 原溶液中c(Fe3+)=0.2 molL﹣1
C. SO42﹣、NH4+、Na+一定存在,CO32﹣、Al3+一定不存在
D. 取少量原溶液并加入KSCN溶液,呈血红色,说明该溶液一定没有Fe2+,只有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+1/2O2(g)=H2O(g)
反应过程中能量变化如下图:
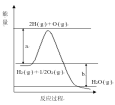
回答下列问题:
(1)图中a,b分别代表什么意义?
a_______________,b______________________。
(2)该反应是____反应(填“吸热”或“放热”),△H____(填“<0”或“>0”)。
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l) ΔH1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g) ΔH2=-393.5kJ/mol
③H2(g)+![]() O2(g)═H2O(l) ΔH3=-285.8kJ/mol
O2(g)═H2O(l) ΔH3=-285.8kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式__________________。
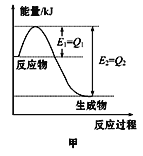
(4)图甲是一定的温度和压强下N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(ΔH的数值用含字母Q1、Q2的代数式表示):___________。
(5)科学家寻找高效催化剂实现大气污染物转化:2CO(g)+2NO(g)N2(g)+2CO2(g)△H1
已知:CO的燃烧热△H2=-283kJ·moL-1。几种化学键的键能数据如下:
化学键 | N≡N键 | O=O键 | N |
键能/kJ·moL-1 | 945 | 498 | 630 |
N2(g)+O2(g)=2NO(g)△H3=____________,上述反应的△H1=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.H2(g)+I2(g) ![]() 2HI(g) ,其他条件不变,缩小反应容器体积,正逆反应速率不变
2HI(g) ,其他条件不变,缩小反应容器体积,正逆反应速率不变
B.C(s)+H2O(g) ![]() H2(g)+CO(g) ,碳的质量不再改变说明反应已达平衡
H2(g)+CO(g) ,碳的质量不再改变说明反应已达平衡
C.若压强不再随时间变化能说明反应 2A(?)+B(g) ![]() 2C(?) 已达平衡,则AC 不能同时是气体
2C(?) 已达平衡,则AC 不能同时是气体
D.C(s)+H2O(g) ![]() H2(g)+CO(g) ,将固态碳粉碎,不可加快化学反应速率。
H2(g)+CO(g) ,将固态碳粉碎,不可加快化学反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿物样品(已经剔除其它杂质)含三种氧化物:Al2O3、Fe2O3、CuO,化学兴趣小组欲将三种金属化合物加以分离,最终制得相应的纯净化合物或溶液。实验方案大致如下:
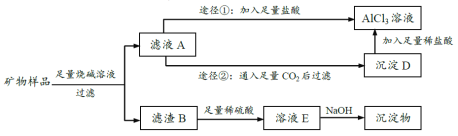
(1)纯Fe2O3、CuO的颜色依次是________色、________色。
(2)写出滤液A的主要溶质成分______________________________。
(3)由滤液A制AlCl3溶液有①和②两种途径,②与①相比自有其合理之处,理由是________。
(4)溶液E中含有三种阳离子。向E中分步滴加NaOH溶液,三种阳离子先后与OH-结合,其中列第二位的阳离子能使某种试剂变为血红色,这种试剂是_________。
(5)若矿物样品的质量为m1,所得Fe(OH)3的质量为m2,则样品中Fe2O3的质量分数为________。若使Fe3+沉淀这一步加入的NaOH过量,该测定值将______(填“偏高”、“偏低”或“不变”))。
(6)将Cu(OH)2溶于稀硫酸,然后制成胆矾晶体,必要的操作步骤依次包括:蒸发浓缩、_______、________、洗涤、自然干燥等。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com