
【题目】已知H2(g)+1/2O2(g)=H2O(g)
反应过程中能量变化如下图:
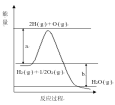
回答下列问题:
(1)图中a,b分别代表什么意义?
a_______________,b______________________。
(2)该反应是____反应(填“吸热”或“放热”),△H____(填“<0”或“>0”)。
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l) ΔH1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g) ΔH2=-393.5kJ/mol
③H2(g)+![]() O2(g)═H2O(l) ΔH3=-285.8kJ/mol
O2(g)═H2O(l) ΔH3=-285.8kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式__________________。
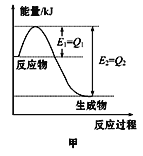
(4)图甲是一定的温度和压强下N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(ΔH的数值用含字母Q1、Q2的代数式表示):___________。
(5)科学家寻找高效催化剂实现大气污染物转化:2CO(g)+2NO(g)N2(g)+2CO2(g)△H1
已知:CO的燃烧热△H2=-283kJ·moL-1。几种化学键的键能数据如下:
化学键 | N≡N键 | O=O键 | N |
键能/kJ·moL-1 | 945 | 498 | 630 |
N2(g)+O2(g)=2NO(g)△H3=____________,上述反应的△H1=_____________。
【答案】活化能 反应热 放热 < 2C(s)+2H2(g)+O2(g)=CH3COOH(l) ![]() = -488.3kJ/mol N2(g)+3H2(g)=2NH3(g)
= -488.3kJ/mol N2(g)+3H2(g)=2NH3(g) ![]() =2(Q1-Q2) kJ/mol +183 kJ/mol -749 kJ/mol
=2(Q1-Q2) kJ/mol +183 kJ/mol -749 kJ/mol
【解析】
(1) 分子变成原子时吸收的能量,为正反应的活化能;生成物的总能量与反应物的总能量的差值是该反应的反应热。
(2)最终放热还是吸热取决于反应物和生成物的能量哪个更高,若反应物能量更高,则是放热反应。
(3)已知几个反应的反应热,求另外一个反应的反应热,可利用盖斯定律求解。
(4)可利用图像数据求出生成物与反应物的能量差,即反应热。
(5)求解反应热的常见方法有两种,一是盖斯定律,一是键能。已知几个反应的反应热,求另外一个反应的反应热,就用盖斯定律,已知反应物和生成物的键能,就用键能求反应热。
(1) 分子变成原子时,断键要吸收能量,所以a代表正反应的活化能;生成物的总能量与反应物的总能量的差值是该反应的反应热,所以b代表反应热。
(2)因为生成物能量更低,所以能量减少,所以是放热反应,△H<0;
(3)根据盖斯定律求解,反应2C(s)+2H2(g)+O2(g)═CH3COOH(l),其![]() =870.3kJ/mol+2×(-393.5kJ/mol)+(-571.6kJ/mol)=-488.3 kJ/mol。
=870.3kJ/mol+2×(-393.5kJ/mol)+(-571.6kJ/mol)=-488.3 kJ/mol。
(4)根据图可知,反应物的总能量比生成物的总能量高,该反应为放热反应,即生成1molNH3(g)时放出的热量为(Q2-Q1)kJ,所以工业合成氨的热化学方程式为N2(g)+3H2(g)=2NH3(g) ![]() =2(Q1-Q2) kJ/mol
=2(Q1-Q2) kJ/mol
(5) 焓变=反应物键能总和-生成物键能总和,则反应N2(g)+O2(g)=2NO(g)![]() =945kJ/mol+498kJ/mol-630kJ/mol×2=+183 kJ/mol ③,CO的燃烧热为-283kJ kJ/mol,即2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol ②,②-③得到2CO(g)+2NO(g)
=945kJ/mol+498kJ/mol-630kJ/mol×2=+183 kJ/mol ③,CO的燃烧热为-283kJ kJ/mol,即2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol ②,②-③得到2CO(g)+2NO(g)![]() N2(g)+2CO2(g),所以2CO(g)+2NO(g)
N2(g)+2CO2(g),所以2CO(g)+2NO(g)![]() N2(g)+2CO2(g),△H1=-566kJ/mol-183 kJ/mol =-749 kJ/mol。
N2(g)+2CO2(g),△H1=-566kJ/mol-183 kJ/mol =-749 kJ/mol。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.标准状况下,将22.4 LHCl溶于1 L水,可配成1 mol/L的稀盐酸
B.把200 mL3 mol/L的MgCl2溶液跟100 mL3 mol/L的KCl溶液混合后,溶液中的Cl-的物质的量浓度仍然是3 mol/L
C.用胆矾(CuSO45H2O)配制500 mL5 mol/L的CuSO4溶液,需胆矾40 g
D.将0.1 mol NaCl配成100 mL溶液,从中取出10 mL,所取出溶液的物质的量浓度为1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用碱式溴化镁废渣[主要成分为Mg(OH)Br,还含有少量有机溶剂及高分子化合物]生产C2H5Br(不溶于水,密度为1.46g/cm3)和MgCl2·6H2O,既可减少污染又可得化工原料,有关工艺流程如图所示:

回答下列问题:
(1)碱式溴化镁溶于盐酸时,1molMg(OH)Br消耗0.5mol/L的盐酸体积为_______________。
(2)分离Ⅰ操作为_______________(操作名称);分离Ⅱ操作时所需的玻璃仪器为_______________。
(3)提溴时,溶液预热至60℃时开始通入氯气,一段时间后,溶液的温度会自然升高到100℃,说明提溴反应为_______________(填“放热”或“吸热”)反应。提溴废液需减压、蒸发、浓缩的目的是_______________。
(4)在浓硫酸催化下,合成溴乙烷粗品的化学方程式为_______________;
(5)精制溴乙烷的步骤为水洗、Na2SO3溶液洗涤、水洗及干燥,其中Na2SO3溶液洗涤的目的是_______________。
(6)用惰性电极在一定条件下电解MgCl2溶液可制取催熟剂氯酸镁,该电解反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在密闭容器内进行着某一反应,X 气体、Y 气体的物质的量随反应时间变化的曲线如右图。下列叙述中正确的是
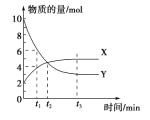
A. 反应的化学方程式为5Y![]() X B. t1 时,Y 的浓度是 X 浓度的1.5 倍
X B. t1 时,Y 的浓度是 X 浓度的1.5 倍
C. t2 时,正、逆反应速率相等 D. t3 时,逆反应速率大于正反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某些有机物之间的相互转化可以储存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)。已知: ①C7H8(l)(NBD)+9O2(g)=7CO2(g)+4H2O(l) ΔH1,②C7H8(l)(Q)+9O2(g)=7CO2(g)+4H2O(l) ΔH2,③
![]()
![]() ΔH=+88.62 kJ·mol-1。下列叙述不正确的是( )
ΔH=+88.62 kJ·mol-1。下列叙述不正确的是( )
A. ΔH1>ΔH2 B. NBD的能量比Q的能量高
C. NBD比Q稳定 D. NBD转化为Q是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol/L的NaHSO3溶液中有如下关系:c(Na+)>c(HSO3-) >c(SO32-) >c(H2SO3),向NaHSO3溶液中慢慢地加入少量的NaOH溶液,发生的主要反应的离子方程式为
A.SO32-+H2O![]() HSO3-十OH—B.HSO3-十H2O
HSO3-十OH—B.HSO3-十H2O![]() H2SO3十OH-
H2SO3十OH-
C.HSO3-十OH—![]() SO32—十H2OD.H2SO3+OH-
SO32—十H2OD.H2SO3+OH-![]() HSO3-十H2O
HSO3-十H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温下气体反应达到化学平衡,平衡常数K=![]() ,恒容时,若温度适当降低,F的浓度增加,下列说法正确的是( )
,恒容时,若温度适当降低,F的浓度增加,下列说法正确的是( )
A.降低温度,正反应速率增大
B.增大c(A)、c(B),K增大
C.向容器中充入稀有气体X,压强增大,反应速率不变
D.该反应的化学方程式为2E(g)+F(s)![]() A(g)+2B(g)
A(g)+2B(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量是( )
A. 1.4gB. 2.2gC. 4.4gD. 在2.2g和4.4g之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略)。请回答:
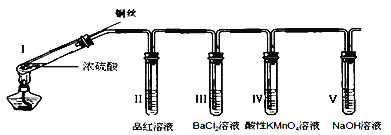
(1)下列说法正确的是__________。
A.反应后,将试管Ⅰ中的白色固体加入水中,溶液呈蓝色
B.取下试管Ⅲ并不断振荡,试管中出现浑浊,是因为生成了BaSO4
C.试管Ⅳ中KMnO4溶液褪色,说明SO2具有氧化性
D.试管V中的NaOH溶液可用Na2CO3溶液代替
(2)取下试管Ⅱ,在该试管口套上气球,将无色溶液加热恢复至红色,冷却后,发现溶液颜色再次变浅。解释“无色→红色→颜色变浅”变化的原因______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com