
【题目】在0.1 mol/L的NaHSO3溶液中有如下关系:c(Na+)>c(HSO3-) >c(SO32-) >c(H2SO3),向NaHSO3溶液中慢慢地加入少量的NaOH溶液,发生的主要反应的离子方程式为
A.SO32-+H2O![]() HSO3-十OH—B.HSO3-十H2O
HSO3-十OH—B.HSO3-十H2O![]() H2SO3十OH-
H2SO3十OH-
C.HSO3-十OH—![]() SO32—十H2OD.H2SO3+OH-
SO32—十H2OD.H2SO3+OH-![]() HSO3-十H2O
HSO3-十H2O
科目:高中化学 来源: 题型:
【题目】环戊二烯可用于制备二茂铁 [Fe(C5H5)2];二茂铁分子是一种金属有机配合物,结构如图所示,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。下列说法正确的是
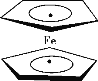
A.1 mol环戊二烯( ![]() )中含有5 mol σ键
)中含有5 mol σ键
B.环戊二烯分子中所有原子共平面
C.二茂铁分子中存在配位键
D.Fe2+的价电子排布式为3d44s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A,由C、H、O三种元素组成,在一定条件下,由A可以转化为有机物B、C、D、E;C又可以转化为B、D。它们的转化关系如下:已知D的蒸气密度是氢气的22倍,并可以发生银镜反应。
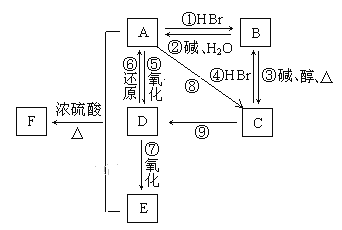
(1)写出A、D、的结构简式和所含官能团名称A_______、________,D__________、___________
(2)写出反应⑤的化学方程式___________________________________;
(3)从组成上分析反应⑨是___________(填反应类型)。
(4)F的同分异构体中能与NaOH溶液发生反应的共_______种(包含F),写出其中一种与NaOH溶液反应的化学方程式______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Cl﹣、SO42﹣、CO32﹣、NH4+、Fe3+、Fe2+、Al3+ 和Na+.某同学为了确认其成分,取部分试液,设计并完成了如下实验:由此可知原溶液中
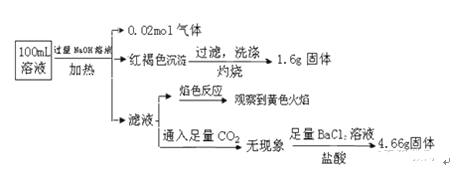
A. 溶液中至少有4种离子存在,其中Cl﹣一定存在,且c(Cl﹣)≥0.2 molL﹣1
B. 原溶液中c(Fe3+)=0.2 molL﹣1
C. SO42﹣、NH4+、Na+一定存在,CO32﹣、Al3+一定不存在
D. 取少量原溶液并加入KSCN溶液,呈血红色,说明该溶液一定没有Fe2+,只有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+1/2O2(g)=H2O(g)
反应过程中能量变化如下图:
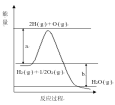
回答下列问题:
(1)图中a,b分别代表什么意义?
a_______________,b______________________。
(2)该反应是____反应(填“吸热”或“放热”),△H____(填“<0”或“>0”)。
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l) ΔH1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g) ΔH2=-393.5kJ/mol
③H2(g)+![]() O2(g)═H2O(l) ΔH3=-285.8kJ/mol
O2(g)═H2O(l) ΔH3=-285.8kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式__________________。
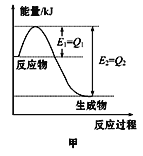
(4)图甲是一定的温度和压强下N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(ΔH的数值用含字母Q1、Q2的代数式表示):___________。
(5)科学家寻找高效催化剂实现大气污染物转化:2CO(g)+2NO(g)N2(g)+2CO2(g)△H1
已知:CO的燃烧热△H2=-283kJ·moL-1。几种化学键的键能数据如下:
化学键 | N≡N键 | O=O键 | N |
键能/kJ·moL-1 | 945 | 498 | 630 |
N2(g)+O2(g)=2NO(g)△H3=____________,上述反应的△H1=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。 制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如下:
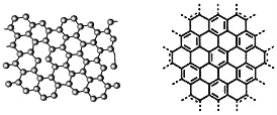
(1)下列有关石墨烯说法正确的是_____。
A 石墨烯的结构与金刚石相似 B 石墨烯分子中所有原子可以处于同一平面
C 12g 石墨烯含σ键数为 NA D 从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含 碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为:_____。
②乙醇沸点比氯乙烷高,主要原因是___________________。
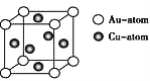
③下图是金与铜形成的金属互化物合金,它的化学式可表示为:_______ 。
④含碳源中属于非极性分子的是______________(填序号)
a 甲烷 b 乙炔 c 苯 d 乙醇
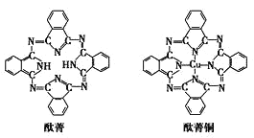
⑤酞菁与酞菁铜染料分子结构如下图,组成酞菁铜染料分子的元素,酞菁变成酞菁铜,分子中多 了什么作用力_____,酞菁铜分子中设计到的元素,电负性由小到大依次为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.H2(g)+I2(g) ![]() 2HI(g) ,其他条件不变,缩小反应容器体积,正逆反应速率不变
2HI(g) ,其他条件不变,缩小反应容器体积,正逆反应速率不变
B.C(s)+H2O(g) ![]() H2(g)+CO(g) ,碳的质量不再改变说明反应已达平衡
H2(g)+CO(g) ,碳的质量不再改变说明反应已达平衡
C.若压强不再随时间变化能说明反应 2A(?)+B(g) ![]() 2C(?) 已达平衡,则AC 不能同时是气体
2C(?) 已达平衡,则AC 不能同时是气体
D.C(s)+H2O(g) ![]() H2(g)+CO(g) ,将固态碳粉碎,不可加快化学反应速率。
H2(g)+CO(g) ,将固态碳粉碎,不可加快化学反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置
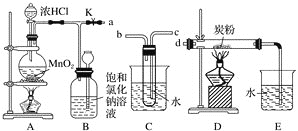
(1)要将C装置接入B和D之间,正确的接法是:a→________→________→ d 。
(2)实验开始先点燃A处的酒精灯,打开活塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为__________________________________________。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是_________________________________________________________________。
(3) D处反应完毕后,关闭弹簧夹K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是_________________________________________________________,B的作用是______________________________________________________。
(4)A、B、C、D、E装置中有一处需要改进,说明需要改进的理由并在方框中画出改进后的装置图。
__________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中进行如下反应:X2(g)+3Y2(g) ![]() 2Z(g),X2、Y2、Z的起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不正确的是( )
2Z(g),X2、Y2、Z的起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不正确的是( )
A.X2为0.3 mol·L-1、Y2为0.9 mol·L-1
B.Y2为1.0 mol·L-1
C.X2为0.3 mol·L-1、Z为0.2 mol·L-1
D.Z为0.8 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com