
【题目】在恒容密闭容器中进行如下反应:X2(g)+3Y2(g) ![]() 2Z(g),X2、Y2、Z的起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不正确的是( )
2Z(g),X2、Y2、Z的起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不正确的是( )
A.X2为0.3 mol·L-1、Y2为0.9 mol·L-1
B.Y2为1.0 mol·L-1
C.X2为0.3 mol·L-1、Z为0.2 mol·L-1
D.Z为0.8 mol·L-1
【答案】D
【解析】
在恒容密闭容器中进行如下反应:X2(g)+3Y2(g) ![]() 2Z(g),X2、Y2、Z的起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,若反应物完全转化为生成物,则X2、Y2、Z的浓度分别为0、0、0.8 mol·L-1;若生成物完全转化为反应,则X2、Y2、Z的浓度分别为0.4 mol·L-1、1.2 mol·L-1、0。由于可逆反应达到平衡状态时,反应混合物中任一组分的浓度不可能为0,因此,各组分的浓度应在0和极值之间。
2Z(g),X2、Y2、Z的起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,若反应物完全转化为生成物,则X2、Y2、Z的浓度分别为0、0、0.8 mol·L-1;若生成物完全转化为反应,则X2、Y2、Z的浓度分别为0.4 mol·L-1、1.2 mol·L-1、0。由于可逆反应达到平衡状态时,反应混合物中任一组分的浓度不可能为0,因此,各组分的浓度应在0和极值之间。
A. X2为0.3 mol·L-1、Y2为0.9 mol·L-1在合理的范围内,且两者比例与投料比及化学计量数之比相同,故有可能;
B. Y2为1.0 mol·L-1在合理的范围内,故有可能;
C. X2为0.3 mol·L-1、Z为0.2 mol·L-1在合理的范围内,且两者的变化量之比与化学计量数之比相同,故有可能;
D. Z为0.8 mol·L-1时,反应物的浓度变为0,该数据肯定不正确。
综上所述,数据肯定不正确的是D,故选D。


科目:高中化学 来源: 题型:
【题目】在0.1 mol/L的NaHSO3溶液中有如下关系:c(Na+)>c(HSO3-) >c(SO32-) >c(H2SO3),向NaHSO3溶液中慢慢地加入少量的NaOH溶液,发生的主要反应的离子方程式为
A.SO32-+H2O![]() HSO3-十OH—B.HSO3-十H2O
HSO3-十OH—B.HSO3-十H2O![]() H2SO3十OH-
H2SO3十OH-
C.HSO3-十OH—![]() SO32—十H2OD.H2SO3+OH-
SO32—十H2OD.H2SO3+OH-![]() HSO3-十H2O
HSO3-十H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质属于同系物关系的是( )
①CH4和C16H34
②CH2=CH—CH3和C4H8
③C3H4和CH2=CHCl
④CH3—C![]() C—C2H5和CH2=CH—CH=CH2
C—C2H5和CH2=CH—CH=CH2
⑤(CH3)2C=CH—CH=CH2和(CH3)3C—C![]() CH
CH
A.①③B.①②C.④D.①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 醋酸由于成本较低,在生产中被广泛应用。
(1)近年来化学家研究开发出用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,不必生产乙醇或乙醛作中间体,使产品成本降低,具有明显经济优势。其合成的基本反应如下:CH2=CH2(g)+CH3COOH(l)![]() CH3COOC2H5(l)下列描述能说明恒温恒容条件下乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是________(填字母)。
CH3COOC2H5(l)下列描述能说明恒温恒容条件下乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是________(填字母)。
A.乙烯、乙酸、乙酸乙酯的浓度相同
B.酯化合成反应的速率与酯分解反应的速率相等
C.乙烯断开1mol碳碳双键的同时乙酸恰好消耗 1 mol
D.整个体系中乙烯的质量分数一定
E.气体的总压强不变
F.气体的摩尔质量不变
(2)在n(乙烯)与n(乙酸)物料比为1的条件下,某研究小组在不同压强下进行了在相同时间乙酸乙酯的产率随温度变化的测定实验,实验结果如图所示。回答下列问题:
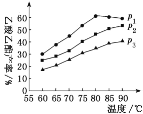
①根据上图判断压强大到小的顺序是________,分析其原因_____。
②压强为p1、温度为60℃时,若乙酸的转化率为40%,则此时乙烯的转化率为____。
③在压强为p1、温度超过80℃时,分析乙酸乙酯产率下降的原因:_____
④根据测定实验结果分析,较适宜的生产条件是________(填出合适的压强和温度)。为提高乙酸乙酯的合成速率和产率,可以采取的措施有___________(任写出一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略)。请回答:
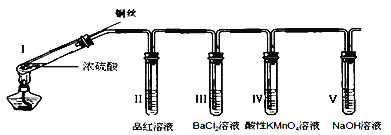
(1)下列说法正确的是__________。
A.反应后,将试管Ⅰ中的白色固体加入水中,溶液呈蓝色
B.取下试管Ⅲ并不断振荡,试管中出现浑浊,是因为生成了BaSO4
C.试管Ⅳ中KMnO4溶液褪色,说明SO2具有氧化性
D.试管V中的NaOH溶液可用Na2CO3溶液代替
(2)取下试管Ⅱ,在该试管口套上气球,将无色溶液加热恢复至红色,冷却后,发现溶液颜色再次变浅。解释“无色→红色→颜色变浅”变化的原因______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为162的有机化合物M,用于调制食用香精,分子中碳、氢原子数相等,且为氧原子数的5倍,分子中只含有一个苯环且苯环上只有一个取代基。芳香烃A的核磁共振氢谱谱图有6个峰,其面积之比为1∶2∶2∶2∶1∶2。用芳香烃A为原料合成M的路线如下:
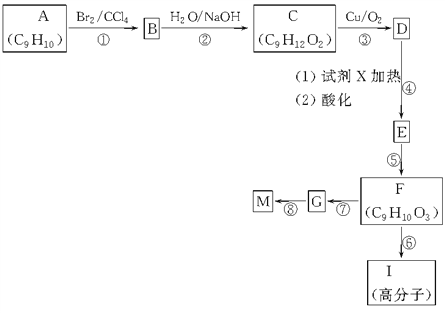
试回答下列问题:
(1)A的结构简式为________,F中的官能团名称是________。
(2)试剂X的名称可能是________。
(3)反应①~⑧中属于取代反应的是________(填反应代号,下同),属于酯化反应的是________,属于加成反应的是________,属于消去反应的是________。
(4)M能发生的反应类型有________(填序号)。
①取代反应 ②加成反应 ③消去反应 ④加聚反应 ⑤缩聚反应
(5)完成下列化学方程式:
F→I:______________________________________________。
G→M:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为CuSO45H2O(s)═CuSO4(s)+5H2O(l)△H=+Q2kJmol-1则Q1、Q2的关系为
A. Q1<Q2 B. Q1>Q2 C. Q1=Q2 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然化合物α-damascone可用于制作“香水”,其结构为: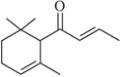 有关该化合物的下列说法不正确的是
有关该化合物的下列说法不正确的是
A.分子式为C13H20OB.该化合物可发生聚合反应
C.1 mol该化合物完全燃烧消耗19 mol O2D.与溴的CCl4溶液反应生成的产物经水解、稀硝酸酸化后可用AgNO3溶液检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
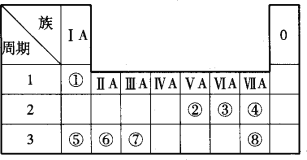
(1)在元素①~⑧中,非金属性最强的元素是____________(填元素名称)。
(2)在元素①~⑧中,原子半径最大的是___________(填元素名称)。
(3)元素⑤⑥⑦的最高价氧化物对应水化物,按碱性从强到弱的顺序排列是____________(用化学式表示)。
(4)用电子式表示元素①和⑧组成的化合物的形成过程____________。
(5)为验证ⅦA族部分元素非金属性的递变规律,设计了如图所示装置进行实验,请回答:
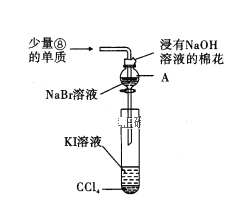
①仪器A的名称是_____, A中发生反应的离子方程式是_______。
②棉花中浸有的NaOH溶液的作用是(用离子方程式表示)___________。
③为验证溴与碘非金属性强弱:通入少量⑧的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到____。
④ⅦA族元素非金属性随元素核电荷数增加而逐渐减弱的原因:同主族元素从上到下,______,得电子能力逐渐减弱。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com