
����Ŀ����100mL NaOH��Һ��ͨ��һ������CO2���壬��ַ�Ӧ������������Һ��μ���0.2mol��L1�����ᣬ����CO2������������������֮���ϵ����ͼ��ʾ�������ж���ȷ���ǣ� ��

A. ԭNaOH��Һ��Ũ��Ϊ0.1mol��L1
B. ͨ��CO2�����Ϊ448mL
C. ������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaHCO3)��n(Na2CO3)=2��1
D. ������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaOH)��n(Na2CO3)=1��3
���𰸡�C
��������
A������100mL����ʱ������̼����������ʱ��ҺΪNaCl��Һ�����������ӡ��������غ㣬n��NaOH��=n��NaCl��=n��HCl�����ݴ˼�����������Ƶ����ʵ������ٸ������ʵ���Ũ�ȵĶ�����㣻
B����25mL��100mLΪ̼�����������ᷴӦ���ɶ�����̼����������HCl�����ʵ��������ݷ���ʽ�������ɶ�����̼�����ʵ������ٸ���V=nVm���������̼�������
CD������CO2�����ķ�ӦΪ��NaHCO3+HCl=NaCl+CO2��+H2O������NaOH��CO2���巴Ӧ������Һ��ֻ��Na2CO3����ʼ�η�����Ӧ��Na2CO3+HCl=NaHCO3+NaCl���ɷ���ʽ��֪��ǰ��������������������Ӧ��ȣ���ʵ�����ɶ�����̼���ĵ���������࣬��NaOH��CO2���巴Ӧ������Һ������ΪNa2CO3��NaHCO3������������������ȷ���������ʵ���֮�ȣ�
����CO2�����ķ�ӦΪ��NaHCO3+HCl=NaCl+CO2��+H2O������NaOH��CO2���巴Ӧ������Һ��ֻ��Na2CO3����ʼ�η�����Ӧ��Na2CO3+HCl=NaHCO3+NaCl���ɷ���ʽ��֪��ǰ��������������������Ӧ��ȣ���ʵ�����ɶ�����̼���ĵ���������࣬��NaOH��CO2���巴Ӧ������Һ������ΪNa2CO3��NaHCO3��
A������100mL����ʱ������̼����������ʱ��ҺΪNaCl��Һ�����������ӡ��������غ㣬����n��NaOH��=n��NaCl��=n��HCl��=0.1L��0.2mol��L��1=0.02mol������c��NaOH��=0.02mol/0.1L=0.2mol��L��1����A����
B�������߿�֪��25mL��100mLΪ̼�����������ᷴӦ���ɶ�����̼����Ӧ����ʽΪNaHCO3+HCl=NaCl+CO2��+H2O������n��CO2��=n��HCl��=��0.1L-0.025L����0.2mol��L��1=0.015mol������CO2�������Ϊ0.015mol��22.4L��mol��1=0.3.6L=336mL����B����
C��Na2CO3ת��ΪNaHCO3��������Ϊ25mL������NaHCO3ת��Ϊ������̼�ֿ�����������25mL����NaOH��CO2���巴Ӧ������Һ��NaHCO3��������������Ϊ75mL-25mL=50mL����Na2CO3��NaHCO3�����ʵ���֮��Ϊ25mL��50mL=1��2��������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaHCO3):n(Na2CO3)=2:1����C��ȷ��
D����C������������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaHCO3):n(Na2CO3)=2:1����D����
��ѡC��


 ���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڽ��������ʿ�����������ȷ���ǣ� ��
A. �ӽ��������л�ý����ǽ���Ԫ�ر������Ĺ���
B. ��HgO�л�ý���Hg����ֱ���ü��ȷֽ�ķ���
C. ��NaCl�л�ý���Na���û�ԭ����ԭ
D. ��Fe2O3�л�ý���Fe����ҵ�ϳ��õ�ⷨ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֻ���������Mg(HSO3)2����Al(OH)3 ��Na[Al(OH)4]�� ��(NH4)2CO3����Al2O3���������NaOH��Һ����Ӧ����
A. �ڢ� B. �٢ڢ� C. �٢ڢܢ� D. �ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ��ˮ������������(����)
A.Cl2+H2O�THCl+HClOB.2F2+2H2O�T4HF+O2
C.2Na+2H2O�T2NaOH+H2��D.CaO+H2O�TCa(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к��Ȳⶨʵ�������˵������ȷ����
A. �ձ�����������ĭ�����Ǽ���ʵ������е�������ʧ
B. ʹ�û��β���������ȿ��Խ����ֱ������¶ȼ�
C. ��ʢװ����ձ��мӼ�ʱҪС�Ļ���
D. �������¶ȼ�Ҫ��ˮ��ϴ���ٲ����¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����200mL�Ȼ�þ���Ȼ����Ļ��Һ�У�Mg2+�����ʵ���Ũ��Ϊ0.2mol��L1��Cl�����ʵ���Ũ��Ϊ1.3mol��L1��ҪʹMg2+ȫ��ת��Ϊ�������������������Ҫ����4mol��L1NaOH��Һ�����Ϊ�� ��
A. 40mLB. 72mLC. 80mLD. 128mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽����ҵ�к�����������ͭ�ĺϽ���ϵ������ã�ijͬѧ��������»��շ�����
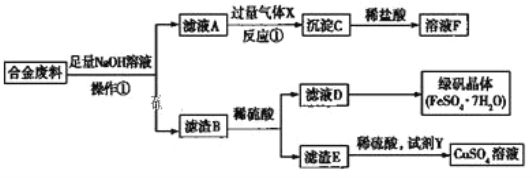
![]() ����
����![]() ��������___________������B����_______________________ ���ѧʽ����
��������___________������B����_______________________ ���ѧʽ����
![]() �Ͻ������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��____________________________________��
�Ͻ������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��____________________________________��
![]() ��Ӧ
��Ӧ![]() �����ӷ���ʽ��___________________________________��
�����ӷ���ʽ��___________________________________��
![]() ��Ҫ����ҺD�еõ��̷����壬������е�ʵ�������_____________����ȴ�ᾧ�����ˡ�ϴ�ӡ��������һϵ�в�����û���õ���������_________________������ţ���
��Ҫ����ҺD�еõ��̷����壬������е�ʵ�������_____________����ȴ�ᾧ�����ˡ�ϴ�ӡ��������һϵ�в�����û���õ���������_________________������ţ���
A��©��![]() ����
����![]() �ձ�
�ձ�![]() ������
������
![]() �Լ�YӦ����һ��____________��������������������ԭ������������������______������ţ���
�Լ�YӦ����һ��____________��������������������ԭ������������������______������ţ���
A��H2O2 B��H2 C��O2 D��Fe
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Һ�д����������������(����)
A.���д���Al3+����Һ��Na+��SO42����Cl��
B.��ʹ��̪������Һ��Na+��Ca2+��CO32��
C.���д���Fe3+����Һ��OH����Mg2+��Cl��
D.���д���HCO3������Һ��H+��SO42����Cl��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com