
【题目】A、B、C、D四种短周期元素,0.5molA的元素的离子得到NA个电子后被还原为中性原子;0.4gA的氧化物恰好与100mL0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等.B元素原子核外电子数比A元素原子核外电子数多1;C﹣离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层电子数的2倍.请填写下列空格:
(1)推断A、B、C、D四种元素的符号A_____;B_____;C_____;D_____;
(2)C的一价阴离子的结构示意图_____;
(3)D元素的最高价氧化物的结构式是_____;
(4)C、D两元素形成的化合物电子式_____,分子内含有_____键 (填极性或非极性).
(5)用电子式表示A、C两元素形成的化合物的过程_____.
【答案】Mg Al Cl C ![]() O=C=O
O=C=O 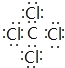 极性
极性 ![]()
【解析】
短周期元素A、B、C、D中,0.5mol A元素的离子得到NA个电子被还原为中性原子,则A离子带两个单位正电荷,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,HCl的物质的量=0.1L×0.2mol/L=0.02mol,由AO+2HCl═ACl2+H2O,可知0.4gAO的物质的量为0.01mol,则M(AO)=0.4g/0.01mol=40g/mol,故A的摩尔质量为40g/mol-16g/mol=24g/mol,A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素原子核外电子数比A元素原子核外电子数多1,则B为Al;C-比A元素的离子多1个电子层,则C的质子数为18-1=17,即C为Cl元素;D元素原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,即D为C元素,以此解答。
(1)综上所述,A为Mg,B为Al,C为Cl,D为C;
答案: Mg Al Cl C
(2)Cl的质子数为17,离子结构示意图为![]() ;
;
答案:![]()
(3)D为碳元素,最高价氧化物为CO2,分子内C原子与O原子之间形成2对共用电子对,其结构式为:O=C=O;
答案:O=C=O
(4)C、D两元素形成的化合物为CCl4,属于共价化合物,存在4个C-Cl键,电子式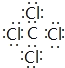 ,分子内含有极性键;
,分子内含有极性键;
答案: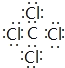 极性
极性
(5)Cl、Mg两元素形成的化合物为MgCl2,MgCl2属于离子化合物,Mg最外层两个电子被两个Cl原子得到,用电子式表示形成过程为:![]() ;
;
答案:![]()


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】假定把12C的相对原子质量定为24,把24g12C含有的原子个数定为阿伏加德罗常数,而物质的量的概念不变。则下列推断不正确的是
A. 此时16O的相对原子质量为32
B. 40gNaOH溶于水配成1L溶液,其物质的量浓度为1 mol/L
C. 标况下44gCO2的体积为22.4L
D. NA个氧分子与NA个氢分子有相同数目的分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化亚铜可用作工业催化剂,是一种白色粉末,微溶于冷水,不溶于乙醇等有机溶剂,在热水中或见光都会分解,在空气中会慢慢氧化成绿色粉末。制备CuBr的实验步骤如下:

步骤1.在如上图所示的三颈烧瓶中加入45gCuSO4·5H2O、19gNaBr、150mL煮沸过的蒸馏水,60℃时不断搅拌,以适当流速通入SO2 2小时。
步骤2.溶液冷却后倾去上层清液,在避光的条件下过滤。
步骤3.依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤
步骤4.在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3~4h,再经氢气流干燥,最后进行真空干燥。
(1)实验所用蒸馏水需经煮沸,煮沸目的是除去水中的________________(写化学式)。
(2)步骤1中:①三颈烧瓶中反应生成CuBr的离子方程式为__________________;
②控制反应在60℃进行,实验中可采取的措施是____________________;
③说明反应已完成的现象是_____________________ 。
(3)步骤2过滤需要避光的原因是_____________________。
(4)步骤3中洗涤剂需“溶有SO2”的原因是____________________。
(5)欲利用上述装置烧杯中的吸收液(经检测主要含Na2SO3、NaHSO3等)制取较纯净的Na2SO3·7H2O晶体。
请补充实验步骤[须用到SO2(贮存在钢瓶中)、20%NaOH溶液]:
①_________________。
②___________________。
③加入少量维生素C溶液(抗氧剂),蒸发浓缩,冷却结晶。
④过滤,用乙醇洗涤2~3次。⑤放真空干燥箱中干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应的叙述正确的是( )
A.用酒精灯加热Fe(OH)3生成FeOB.实验室加热NH4Cl固体制取NH3
C.SO2和过量氨水反应生成(NH4)2SO3D.Na在空气中燃烧制取Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一定量的铁粉放入含三价铁离子溶液中,反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等,则已反应的Fe3+和未反应的Fe3+物质的量之比是 ( )
A.1:2B.1:1C.3:2D.2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于单质铁的性质,下列说法中正确的是( )
A.铁与高温水蒸气反应生成Fe2O3B.铁与硫单质反应生成Fe2S3
C.生铁是一种铁-碳合金D.常温下,冷的浓硫酸与铁单质不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图,图2中轴表示实验时流入正极的电子的物质的量, y轴表示

A. 铜棒的质量 B. c(H+) C. c(SO42-) D. c(Zn2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是

A. a点的溶液呈中性
B. 从开始到b点发生反应的总的离子方程式是:Al3++2SO42-+2Ba2++3OH-= Al(OH)3↓+2BaSO4↓
C. c点加入Ba(OH)2溶液的体积为200 mL
D. c点溶液呈碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com