
【题目】取m克铁粉与1 L 1.2 mol/L的稀HNO3恰好完全反应,反应后的溶液中只含Fe2+且硝酸的还原产物只有NO。则:
(1)m=______________g。
(2)若将反应后的溶液低温蒸干,析出晶体135 g,则析出晶体的组成可能是_________。
a.Fe(NO3)27H2O和Fe(NO3)24H2O
b.Fe(NO3)27H2O和Fe(NO3)2H2O
c.Fe(NO3)24H2O和Fe(NO3)2H2O
(3)若向反应后的溶液中加入100 mL 1.5 mol/L的稀H2SO4,则标准状态下还能产生NO的体积为______L。
【答案】25.2 a、b 1.68 L
【解析】
铁与硝酸反应生成亚铁离子和NO的方程式为:Fe+4H++NO3-= Fe3++NO↑+2H2O,Fe+2Fe3+=3Fe2+;
(1)根据题意方程式可写为:3Fe+ 8HNO3= 3Fe(NO3)2+2NO↑+ 4H2O,硝酸的物质的量为1 L ×1.2 mol/L=1.2mol,则Fe为![]() =0.45mol,质量为0.45mol ×56g/mol=25.2g;
=0.45mol,质量为0.45mol ×56g/mol=25.2g;
答案为:25.2;
(2)参加反应的Fe为0.45mol,则生成n[Fe(NO3)2 ]=0.45mol,若全部是Fe(NO3)27H2O,则晶体质量为137.7g;若全部为Fe(NO3)24H2O,晶体质量为113.4g;若全部为Fe(NO3)2H2O,晶体质量为89.1g;已知,析出晶体为135g,则平均摩尔质量为![]() =300g/mol,一定含有Fe(NO3)27H2O,至少含有Fe(NO3)24H2O和Fe(NO3)2H2O的一种,
=300g/mol,一定含有Fe(NO3)27H2O,至少含有Fe(NO3)24H2O和Fe(NO3)2H2O的一种,
答案为:a、b;
(3)加入稀硫酸时,发生3Fe2++4H++NO3-= 3Fe3++NO↑+2H2O,溶液中n(Fe2+)=0.45mol,n(H+)=0.3mol,氢离子少量,则产生n(NO)=0.075mol,标况下的体积为1.68L;
答案为:1.68。


科目:高中化学 来源: 题型:
【题目】25℃时,在含CH3COOH和CH3COO-的溶液中, CH3COOH、CH3COO-二者中各自所占的物质的量分数(a)随溶液pH变化的关系如图所示。

下列说法不正确的是
A. 在pH<4.76的溶液中,c(CH3COO-)<c(CH3COOH)
B. 在pH=7的溶液中,a(CH3COOH)=0,a(CH3COO-)=1.0
C. 在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+)
D. 在pH=4.76的溶液中加盐酸,a(CH3COOH)与a(CH3COO-)之和保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将盛有14 mL由二氧化氮和氧气组成的混合气体的量筒倒立于水槽中,充分反应后剩余4 mL气体(相同状况下测定),原混合气体中二氧化氮和氧气的体积分别是多少?____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫等气体与雾霾的形成有关(如图所示)。

(1)过程①中NOx(x=1或2)发生_______(填“氧化”或“还原”)反应。
(2)气体A的化学式是________。
(3)过程②的化学方程式是________。
(4)已知:2H2S(g)+O2(g)=2S(s)+2H2O(l) △H1= -a kJ/mol
S(s)+O2(g)=SO2(g) △H2= -b kJ/mol
家庭常用燃料液化石油气中含有微量H2S,在燃烧过程中会产生SO2。该反应的热化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(室温下与水缓慢反应)是一种新型无机材料,广泛应用于集成电路生产领域。化学研究小组同学按下列流程制取氮化铝并测定所得产物中AlN的质量分数。
己知:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑。
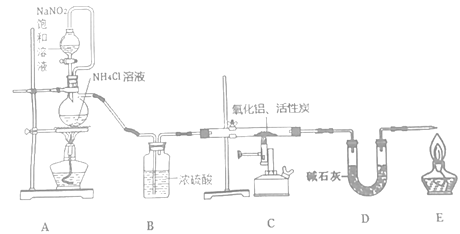
回答下列问题:
(1)检查装置气密性,加入药品,开始实验。最先点燃___(“A”、“C”或“E”)处的酒精灯或酒精喷灯。
(2)装置A中发生反应的离子方程式为___,装置C中主要反应的化学方程式为___,制得的AlN中可能含有氧化铝、活性炭外还可能含有___。
(3)实验中发现氮气的产生速率过快,严重影响尾气的处理。实验中应采取的措施是___(写出一种措施即可)。
(4)称取5.0g装置C中所得产物,加入NaOH溶液,测得生成氨气的体积为1.68 L(标准状况),则所得产物中AlN的质量分数为___。
(5)也可用铝粉与氮气在1000℃时反应制取AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,共主要原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积变化关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
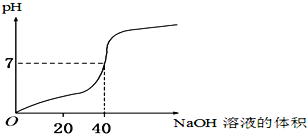
A.1.0 mol/L,20 mL B.0.5 mol/L,40 mL
C.0.5 mol/L,80 mL D.1.0 mol/L,80 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A. 该溶液的pH=4 B. 升高温度,溶液的pH和电离平衡常数均减小
C. 此酸的电离平衡常数约为1×10-7 D. 加入少量纯HA,电离程度减小电离平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中医经典方剂组合对新冠肺炎病毒治疗具有良好的效果。其中的一味中药黄芩的有效成分结构简式如图所示,下列说法错误的是
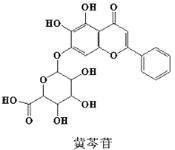
A.黄芩苷是芳香化合物,共含有四种官能团B.黄芩苷可发生取代、加成、氧化、还原反应
C.1mol 黄芩苷最多消耗 3molNaOHD.1 mol 黄芩苷最多与 7mol H2 发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间有如下反应关系:
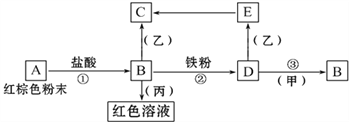
已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:
(1) 写出下列物质的化学式:A______B______D________甲_______乙_______丙__________
(2) 写出E→C反应的化学方程式:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com