


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
| A、2:1:2 | B、5:5:4 |
| C、1:1:1 | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
| 3 |
| 2 |
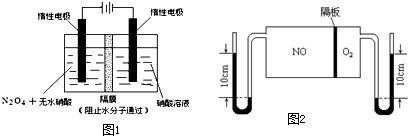
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素在周期表中的位置,反映元素的原子结构和元素的性质.如图是元素周期表的一部分.请用元素符号或化学式填空:
元素在周期表中的位置,反映元素的原子结构和元素的性质.如图是元素周期表的一部分.请用元素符号或化学式填空:查看答案和解析>>
科目:高中化学 来源: 题型:
 12.硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题:
12.硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
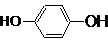



查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
||||||||
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、推广使用燃煤脱硫技术,减少环境污染 |
| B、加大石油、煤炭的开发速度,提倡使用化石燃料 |
| C、实施绿化工程,防治扬尘污染 |
| D、加快清洁能源的开发利用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com