

 Li2SO4 + 2CoSO4 + O2↑+ 4H2O
Li2SO4 + 2CoSO4 + O2↑+ 4H2O 2H2O + O2↑ ;有氯气生成,污染较大。
2H2O + O2↑ ;有氯气生成,污染较大。 Li2SO4 + 2CoSO4 + O2↑+ 4H2O,H2O2自身发生分解反应,2H2O2
Li2SO4 + 2CoSO4 + O2↑+ 4H2O,H2O2自身发生分解反应,2H2O2 2H2O + O2↑;LiCoO2具有较强的氧化性,用盐酸代替H2SO4和H2O2的混合液,氯气生成,污染较大。
2H2O + O2↑;LiCoO2具有较强的氧化性,用盐酸代替H2SO4和H2O2的混合液,氯气生成,污染较大。

科目:高中化学 来源:不详 题型:单选题
 2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)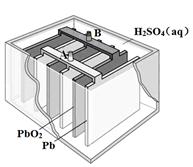
| A.放电时,正极反应为:PbO2(s) + 4H+(aq) + SO42-(aq) +2e- = PbSO4(s) + 2H2O(l) |
| B.充电时,应将外接直流电源的正极与铅蓄电池的接线柱A相接 |
| C.实验室用铅蓄电池做电源精炼粗铜时,应将粗铜与接线柱B相连接 |
| D.铅蓄电池做电源电解Na2SO4溶液时,当有2 mol O2产生时,消耗8 mol H2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
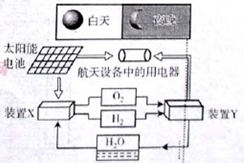
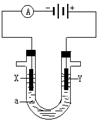
| A.该系统中只存在3种形式的能量转化 |
| B.装置Y中负极的电极反应式为:O2+2H2O+4e—=4OH— |
| C.装置X能实现燃料电池的燃料和氧化剂再生 |
| D.该系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.破损的镀锌铁在潮湿的空气中更易被腐蚀 |
| B.金属腐蚀就是金属原子失去电子被还原的过程 |
| C.当镀锡铁制品的镀层破损时,锡层仍能对铁制品起保护作用 |
| D.在海轮外壳连接锌块保护外壳不受腐蚀是采用了电化学保护法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2PbSO4+2H2O回答下列 问题。(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列 问题。(不考虑氢、氧的氧化还原)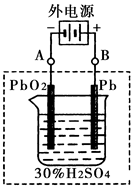
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

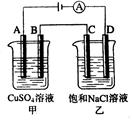
A.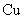 电极上发生还原反应 电极上发生还原反应 |
B.电子沿Zn a a b b Cu路径流动 Cu路径流动 |
| C.片刻后甲池中c(SO42—)增大 |
| D.片刻后可观察到滤纸b点变红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com