
(14分)氨是重要的化工产品之一,研究合成氨反应具有重要意义。
(1) 已知断裂下列化学键需要吸收的能量分别为:
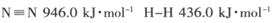
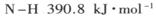 ,
,
写出以N2和H2为原料合成NH3的热化学方程式________________________。
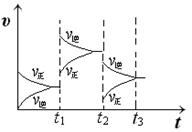
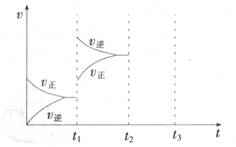
(2) 某小组研究了其他条件不变时,改变某一条件对上述反应的影响,实验结果如下图所示:
①t1时刻改变的条件为__________________。
②t2时刻,恒压充入氦气,t3时刻达到平衡。在图中画出t2时刻后的速率变化图像。

(3) 相同温度下,A、B、C三个密闭容器,A、B恒容,C带有可自由移动的活塞K,各向其中充入如图所示反应物,初始时控制活塞K使三者体积相等,一段时间后均达到平衡。

①达到平衡时,A、C两个容器中NH3的浓度分别为cl、c2,则c1______c2(填“>”、“<”或“=”)。
②达到平衡时,若A、B两容器中反应物的转化率分别为α(A),α(B),则α(A)+α(B)______1(填“ >”、“<”或“=”)。
③达到平衡时,若容器C的体积是起始时的3/4,则平衡时容器C中H2的体积分数为_______。
(4) 直接供氨式碱性燃料电池(DAFC),以KOH溶液为电解质溶液,其电池反应为 4NH3+3O2=2N2+6H2O,则负极的电极反应式为__________________。
(1)N2(g)+3H2(g)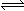 2NH3(g) △H=
-90.8 kJ·mol-1(2分)
2NH3(g) △H=
-90.8 kJ·mol-1(2分)
(2)①升高温度 (2分)
② (2分)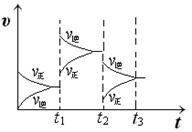
(3)① <(2分) ② < (2分) ③50% (2分)
(4)2NH3—6e—+6OH—=N2+6H2O (2分)
【解析】
试题分析:(1)根据键能关系计算:△H=反应物的键能-生成物的键能=946+436×3-390.8×6=-90.8 kJ·mol-1;N2(g)+3H2(g) 2NH3(g) △H=
-90.8 kJ·mol-1
2NH3(g) △H=
-90.8 kJ·mol-1
(2)①t1时刻正逆反应速率都增大,向逆向移动,则是升高温度;②恒压充入氦气,相当于减压,正逆速率都减小,向逆向移动,如下图
(3) 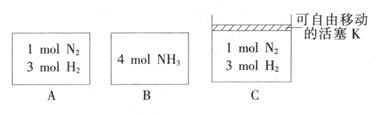
①A恒容,压强减小,C恒压,所以C中压强大于A, c1<c2。
②A中相当于氨气是2mol,B容器中是A中的2倍,压强增大,则反应物的转化率小于A。即1-α(A)>α(B),则α(A)+α(B)<1;
③若容器C的体积是起始时的3/4,则平衡时物质的量是起始时的3/4,
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
起始(mol) 1 3 0
转化(mol) x 3x 2x
平衡(mol) 1-x 3-3x 2x
(4-2x)/4=3/4;x=0.5;则H2的体积分数为1.5÷3=50%
(4)电池总反应为 4NH3+3O2=2N2+6H2O,知道正极反应为:O2+4e-+2H2O=4OH—,由总反应减去正极反应,则负极的电极反应式为2NH3—6e—+6OH—=N2+6H2O。
考点:考查热化学反应方程式书写、化学平衡、燃料电池的书写等。
点评:本题以合成氨为载体,考查了高考的中热点知识:热化学方程式、化学平衡、原电池等知识,综合性强,也是高考的常考内容,平时学习要注意整理这类习题。


科目:高中化学 来源:2013届河北省唐山一中高三第二次月考化学试卷(带解析) 题型:填空题
(14分)氨是重要的化工产品之一,研究合成氨反应具有重要意义。
(1) 已知断裂下列化学键需要吸收的能量分别为:
 ,
,
写出以N2和H2为原料合成NH3的热化学方程式________________________。
(2) 某小组研究了其他条件不变时,改变某一条件对上述反应的影响,实验结果如下图所示:
①t1时刻改变的条件为__________________。
②t2时刻,恒压充入氦气,t3时刻达到平衡。在图中画出t2时刻后的速率变化图像。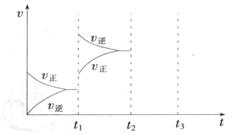
(3) 相同温度下,A、B、C三个密闭容器,A、B恒容,C带有可自由移动的活塞K,各向其中充入如图所示反应物,初始时控制活塞K使三者体积相等,一段时间后均达到平衡。
①达到平衡时,A、C两个容器中NH3的浓度分别为cl、c2,则c1______c2(填“>”、“<”或“=”)。
②达到平衡时,若A、B两容器中反应物的转化率分别为α(A),α(B),则α(A)+α(B)______1(填“ >”、“<”或“=”)。
③达到平衡时,若容器C的体积是起始时的3/4,则平衡时容器C中H2的体积分数为_______。
(4) 直接供氨式碱性燃料电池(DAFC),以KOH溶液为电解质溶液,其电池反应为 4NH3+3O2=2N2+6H2O,则负极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源:2012届河北省石家庄市高三第二次模拟理科综合化学试卷(带解析) 题型:填空题
(14分)氨是重要的化工产品之一,研究合成氨反应具有重要意义。
(1) 已知断裂下列化学键需要吸收的能量分别为:
 ,写出以N2(g)和H2(g)为原料合成NH3(g)的热化学方程式_______________
,写出以N2(g)和H2(g)为原料合成NH3(g)的热化学方程式_______________
(2) 某小组研究了其他条件不变时,改变某一条件对上述反应的影响,实验结果如下图所示:
①t1时刻改变的条件为__________________
②t2时刻,恒压充入氦气,t3时刻达到平衡。在图中画出t2时刻后的速率变化图像。
(3) 相同温度下,A、B、C三个密闭容器,A、B恒容,C带有可自由移动的活塞K,各向其中充人如图所示反应物,初始时控制活塞K,使三者体积相等,一段时间后均达到平衡。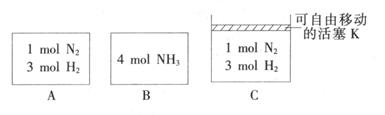
①达到平衡时,A、C两个容器中NH3的浓度分别为cl、c2,则c1______c2(填“>”、“<”或“=”)。
②达到平衡时,若A、B两容器中反应物的转化率分别为 ,则
,则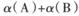 ______1(填“ >”、“<”或“=”)。
______1(填“ >”、“<”或“=”)。
③达到平衡时,若容器C的体积是起始时的 ,则平衡时容器C中H2的体积分数为_______
,则平衡时容器C中H2的体积分数为_______
(4) 直接供氨式碱性燃料电池(DAFC),以KOH溶液为电解质溶液,其电池反应为 4NH3+3O2=2N2+6H2O,则负极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省文登市高三第二次统考理科综合化学试卷(解析版) 题型:填空题
对-甲乙苯(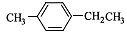 )是一种重要的有机原料,用该物质可合成其他物质。
)是一种重要的有机原料,用该物质可合成其他物质。
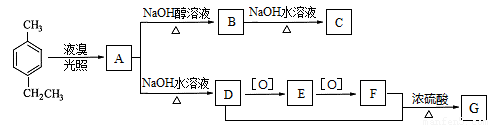
已知:①1molD与足量钠反应可生成1mol氢气;
②D、E、F每种分子中均只含有一种含氧官能团。
③G是一种有机高分子化合物。
回答下列问题:
(1)对-甲乙苯的系统命名为_____________;A的结构简式为____________。
(2) A→B的反应类型为___________;F中含氧官能团的名称为____________。
(3)C在引发剂的作用下,可生成高分子化合物,该高分子化合物的链节为____________。
(4) 1molE和足量银氨溶液反应,生成沉淀的物质的量为___________。
(5) D+F→G的化学方程式为_____________________________________________。
(6)H比D相对分子质量小14,H的同分异构体能同时满足如下条件:①苯环上有两个取代基;②遇氯化铁溶液显紫色;③核磁共振氢谱为六组峰,且峰面积比为2:2:2:2:1:1,写出H的这种同分异构体的简式_________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省石家庄市高三第二次模拟理科综合化学试卷(解析版) 题型:填空题
(14分)氨是重要的化工产品之一,研究合成氨反应具有重要意义。
(1) 已知断裂下列化学键需要吸收的能量分别为: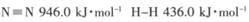
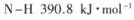 ,写出以N2(g)和H2(g)为原料合成NH3(g)的热化学方程式_______________
,写出以N2(g)和H2(g)为原料合成NH3(g)的热化学方程式_______________
(2) 某小组研究了其他条件不变时,改变某一条件对上述反应的影响,实验结果如下图所示:
①t1时刻改变的条件为__________________
②t2时刻,恒压充入氦气,t3时刻达到平衡。在图中画出t2时刻后的速率变化图像。
(3) 相同温度下,A、B、C三个密闭容器,A、B恒容,C带有可自由移动的活塞K,各向其 中充人如图所示反应物,初始时控制活塞K,使三者体积相等,一段时间后均达到平衡。

①达到平衡时,A、C两个容器中NH3的浓度分别为cl、c2,则c1______c2(填“>”、“<”或“=”)。
②达到平衡时,若A、B两容器中反应物的转化率分别为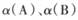 ,则
,则  ______1(填“ >”、“<”或“=”)。
______1(填“ >”、“<”或“=”)。
③达到平衡时,若容器C的体积是起始时的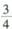 ,则平衡时容器C中H2的体积分数为_______
,则平衡时容器C中H2的体积分数为_______
(4) 直接供氨式碱性燃料电池(DAFC),以KOH溶液为电解质溶液,其电池反应为 4NH3+3O2=2N2+6H2O,则负极的电极反应式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com