
压强/Pa | 2×106 | 5×106 | 1×107 |
D的浓度/mol·L-1 | 0.085 | 0.20 | 0.44 |
根据表中数据,完成下列问题:
(1)压强从2×106Pa增加到1×107Pa时,平衡向____________反应方向移动(填“正”或“逆”),理由是________________________________________。
(2)压强从5×106Pa增加到1×107Pa时,平衡向____________反应方向移动(填“正”或“逆”),此时平衡向该方向移动的两个必要条件是
①_________________________________________________________________。
②_________________________________________________________________。
(1)逆 压强由2×106到5×106,变为原来的2.5倍,若平衡不移动,D的浓度也应变为原来的2.5倍,即浓度应为0.212 5 mol·L-1,现浓度为0.20 mol·L-1,说明平衡向D的物质的量浓度减小的方向移动,即平衡向逆反应方向移动。结合平衡移动原理,加压平衡向气体分子数减小的方向移动。从而得出a<d+e。
(2)正 反应物的气体分子数大于生成物的气体分子数 E在加压后变为液体或固体
解析:当学生没有做过同类型的试题时,很难做对几个空。正确率极低,绝大部分同学只做对第一个空。是什么原因导致此结果的产生呢?虽然我们平时经常接触到“压强变为原来的二倍,某物质如反应物B在平衡时的浓度变为原来的1.6倍,求反应前后气体的分子数的大小关系”这类试题,也会分析此题并得出正确结论(加压时,暂不考虑平衡移动。压强变为原来的二倍,气体的体积变为原来的二分之一,浓度变为原来的二倍。然后再考虑平衡移动的情况。现在反应物B的浓度变为原来的1.6倍,说明平衡向B减小的方向移动,结合平衡移动原理,加压平衡向气体分子数减小的方向移动,从而得出反应物的气体分子数大于生成物的气体分子数)。由于长期做此类题产生了定势思维,所以拿到此类题后,很容易得出正确的结论。但如果试题的变动稍大(如本题),学生简直就不知该如何下手。实际上,解题原理相同。压强由2×106到5×106,变为原来的2.5倍,若平衡不移动,D的浓度也应变为原来的2.5倍,即浓度应为0.212 5 mol·L-1,现浓度为0.20 mol·L-1,说明平衡向D的物质的量浓度减小的方向移动,即平衡向逆反应方向移动。结合平衡移动原理,加压平衡向气体分子数减小的方向移动。从而得出a<d+e。
压强由5×106变为1×107,增大为原来的二倍;浓度由0.20变为0.44,变为原来的2.2倍,说明加压平衡向生成D的方向即正反应方向移动,这时学生们犯疑惑了,这是怎么回事呢?是上面的结论错了,还是勒夏特列原理出了问题?于是大部分同学放弃了此题的求解。其实只要我们重新审查上面的分析,坚信勒夏特列原理不会出错,就会得出另一个意想不到的结论。加压,平衡一定向气体分子数减小的方向移动。原来a<d+e,现在要使a大于产物中气体的分子数,D一定为气体,所以只能是E在加压后变为液体或固体。


科目:高中化学 来源: 题型:阅读理解
(21分)工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为
CO(g)+2H2(g)CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断△H 0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 ,此时的温度为 。
(2)在100℃ 压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的的平衡常数K= (用含a、V的代数式表示并化简至最简单的形式)。此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡_____(向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数 。(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是 。
A.升温 B.加入催化剂 C.增加CO的浓度
D.恒容充入H2 E.恒压充入惰性气体 F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同) 。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2moL H2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 的 数 据 | CH3OH浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 |
请选择正确的序号填空(不定项选择)
(1)c1、c2、c3的关系表达正确的为______
A c3>2c1 B c1<c3<2c1 C c1=c2
(2)a、b、c的关系表达正确的为________
A c<2|△H| B a+b=|△H| C c=2b
(3)p1、p2、p3的关系不正确的为________
A p1=p2 B p2<p3<2p2 C p3>2p2
(4)a1、a2、a3的关系表达不正确的为________
A a1=a2 B a3< a2 C a1+a2=1
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省四校高二零班第一次月考化学试卷(带解析) 题型:填空题
(23分)工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为CO(g)+2H2(g)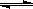 CH3OH(g)△H
CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2moL H2 | 1molCH3OH | 2molCH3OH | |
| 平衡 时的 数据 | CH3OH浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源:2014届江西省四校高二零班第一次月考化学试卷(解析版) 题型:填空题
(23分)工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为CO(g)+2H2(g)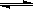 CH3OH(g)△H
CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
|
温度 |
250°C |
300°C |
350°C |
|
K |
2.041 |
0.270 |
0.012 |
①由表中数据判断△H 0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 ,此时的温度为 。
(2)在100℃ 压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的的平衡常数K= (用含a、V的代数式表示并化简至最简单的形式)。此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡 (向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数 。(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是 。
A.升温 B.加入催化剂 C.增加CO的浓度 D.恒容充入H2
E.恒压充入惰性气体 F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同) 。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
|
容器 |
甲 |
乙 |
丙 |
|
|
反应物投入量 |
1molCO、2moL H2 |
1molCH3OH |
2molCH3OH |
|
|
平衡 时的 数据 |
CH3OH浓度(mol/L) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
akJ |
bkJ |
ckJ |
|
|
体系压强(Pa) |
p1 |
p2 |
p3 |
|
|
反应物转化率 |
α1 |
α2 |
α3 |
请选择正确的序号填空(不定项选择)
①c1、c2、c3的关系表达正确的为
A.c3>2c1 B.c1<c3<2c1 C.c1=c2
②a、b、c的关系表达正确的为
A.c<2|△H| B.a+b=|△H| C.c=2b
③p1、p2、p3的关系不正确的为
A.p1=p2 B.p2<p3<2p2 C.p3>2p2
④α1、α2、α3的关系表达不正确的为
A.α1=α2 B.α3<α2 C.α1+α2=1
查看答案和解析>>
科目:高中化学 来源:2013届度本溪市高一下学期期末考试化学试卷 题型:填空题
(19分)工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为
CO(g)+2H2(g)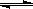 CH3OH(g)△H
CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
|
温度 |
250°C |
300°C |
350°C |
|
K |
2.041 |
0.270 |
0.012 |
①由表中数据判断△H 0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 ,此时的温度为 。
(2)在100℃ 压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的的平衡常数K= (用含a、V的代数式表示并化简至最简单的形式)。此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡___ __(向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数 。(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是 。
A.升温 B.加入催化剂 C.增加CO的浓度
D.恒容充入H2 E.恒压充入惰性气体 F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同) 。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
|
容器 |
甲 |
乙 |
丙 |
|
|
反应物投入量 |
1molCO、2moL H2 |
1molCH3OH |
2molCH3OH |
|
|
平 衡 时 的 数 据 |
CH3OH浓度(mol/L) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
akJ |
bkJ |
ckJ |
|
|
体系压强(Pa) |
p1 |
p2 |
p3 |
|
|
反应物转化率 |
α1 |
α2 |
α3 |
请选择正确的序号填空(不定项选择)
① c1、c2、c3的关系表达正确的为______
A c3>2c1 B c1<c3<2c1 C c1=c2
②p1、p2、p3的关系不正确的为________
A p1=p2 B p2<p3<2p2 C p3>2p2
③ a1、a2、a3的关系表达不正确的为________
A a1=a2 B a3< a2 C a1+a2=1
查看答案和解析>>
科目:高中化学 来源:2010-2011年江苏省高一下学期期末考试化学试卷 题型:选择题
在100 mLH2SO4和CuSO4的混合液中,用石墨作电极电解一段时间,两极均收到2.24L气体(标准状况),则原混合液中,Cu2+的物质的量浓度为 ( )
A.1mol•L―1 B.2mol•L―1 C.3 mol•L―1 D.4 mol•L―1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com