
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 2.00 | 0.00 |
| 1 | 0.90 | 1.80 | 0.20 |
| 3 | 0.75 | 1.50 | 0.50 |
| 5 | 0.65 | 1.30 | 0.70 |
| 9 | 0.55 | 1.10 | 0.90 |
| 10 | 0.55 | 1.10 | 0.90 |
| 14 | 0.55 | 1.10 | 0.90 |
 2Z
2Z分析 由表格中数据可知,9min达到平衡,X减少1.0-0.55=0.45mol,Y减少2.00-1.10=0.90mol,Z增加0.90-0=0.90mol,时间、体积相同,则物质的量变化量之比等于速率之比,也等于化学计量数之比,则反应为X+2Y 2Z,结合v=$\frac{△c}{△t}$、转化率=$\frac{转化的量}{开始的量}$×100%解答.
2Z,结合v=$\frac{△c}{△t}$、转化率=$\frac{转化的量}{开始的量}$×100%解答.
解答 解:①由表格中数据可知,9min达到平衡,X减少1.0-0.55=0.45mol,Y减少2.00-1.10=0.90mol,Z增加0.90-0=0.90mol,时间、体积相同,则物质的量变化量之比等于速率之比,也等于化学计量数之比,则反应为X+2Y 2Z,故答案为:X+2Y
2Z,故答案为:X+2Y 2Z;
2Z;
②在0~5min时间内产物Z的平均反应速率为$\frac{\frac{0.70mol}{10L}}{5min}$=0.014 mol/(L•min),故答案为:0.014 mol/(L•min);
③该反应达到平衡时反应物X的转化率α=$\frac{0.45mol}{1.0mol}$×100%=45%,故答案为:45%.
点评 本题考查化学平衡的计算,为高频考点,把握反应的确定、速率及转化率的计算为解答的关键,侧重分析与计算能力的考查,注意表格数据的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
 用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制100mL该溶液需用5.85g NaCl | |
| B. | 该溶液的物质的量浓度为1mol•L -1 | |
| C. | 该溶液中含有58.5g NaCl | |
| D. | 量取100mL该溶液,其中Na+的物质的量为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 920 mL,107.64 g | B. | 500 mL,117 g | ||
| C. | 1000 mL,117.0g | D. | 任意规格,107.64 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
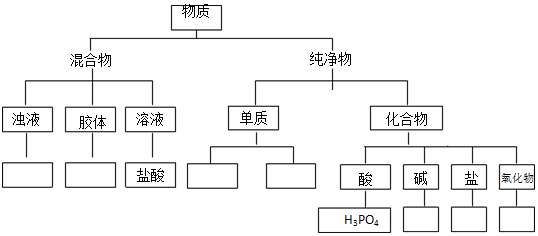
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com