
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
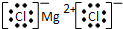 ,故答案为:
,故答案为: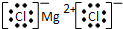 ;
;

科目:高中化学 来源: 题型:
| A、生成的氢气中只含有D2 |
| B、生成的氢气中只含有H2 |
| C、生成的氢气中含有H2、HD、D2 |
| D、以上判断都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
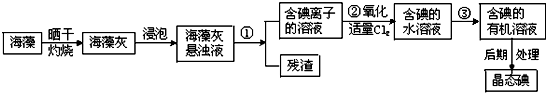
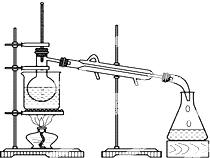
查看答案和解析>>
科目:高中化学 来源: 题型:
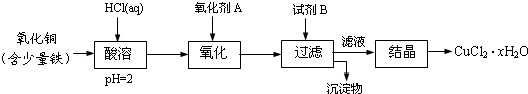
查看答案和解析>>
科目:高中化学 来源: 题型:
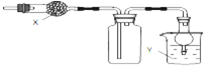
| A、X是碱石灰,收集到的气体是氯化氢,Y是水 |
| B、X是碱石灰,收集到的气体是氨气,Y是水 |
| C、X是氯化钙,搜集到的气体是二氧化硫,Y是氢氧化钠 |
| D、X是氯化钙,收集到的气体是一氧化氮,Y是氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
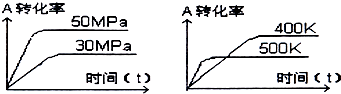 如图表示可逆反应mA(g)+nB(s)?xC(g)在不同温度和压强下,反应物A的转化率变化情况.下列判断正确的是( )
如图表示可逆反应mA(g)+nB(s)?xC(g)在不同温度和压强下,反应物A的转化率变化情况.下列判断正确的是( )| A、m>x,正反应为放热反应 |
| B、m+n<x,正反应为吸热反应 |
| C、m<x,正反应为放热反应 |
| D、m>x,正反应为吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com