

 ,N原子形成3个共价键且由1对孤对电子,N原子为sp3杂化,化合物分子的空间构型是三角锥形,
,N原子形成3个共价键且由1对孤对电子,N原子为sp3杂化,化合物分子的空间构型是三角锥形, ;三角锥形;sp3;
;三角锥形;sp3; ;K为Fe,原子序数为26,位于第四周期第ⅤⅢ族;L为Cu,原子序数为29,其电子排布为[Ar]3d104s1,故答案为:
;K为Fe,原子序数为26,位于第四周期第ⅤⅢ族;L为Cu,原子序数为29,其电子排布为[Ar]3d104s1,故答案为: ;第四周期第ⅤⅢ族;[Ar]3d104s1;
;第四周期第ⅤⅢ族;[Ar]3d104s1;

科目:高中化学 来源: 题型:
| A、上述三个反应都有单质生成,所以都是置换反应 |
| B、氧化性由强到弱顺序为KClO3>KBrO3>Cl2>Br2 |
| C、反应②中还原剂与氧化剂的物质的量之比为5:1 |
| D、③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1-溴丁烷 |
| B、2,2-二甲基-3-溴丁烷 |
| C、3-氯戊烷 |
| D、2-甲基-3-氯戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量过氧化钠投入AlCl3溶液 |
| B、向饱和碳酸钠溶液通入CO2气体 |
| C、向Fe(NO3)2溶液中滴加稀硫酸 |
| D、向碳酸氢钠溶液中滴加氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
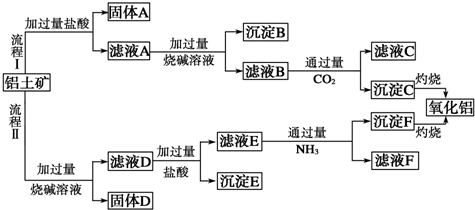
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、较强酸可制较弱酸,次氯酸无法制盐酸 |
| B、Ca(OH)2能制成澄清石灰水,次氯酸无法制盐酸 |
| C、KNO3的溶解度大,用重结晶法除去KNO3中混有的NaCl |
| D、BaSO4难溶于酸,用盐酸和BaCl2溶液检验SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com