
| A、较强酸可制较弱酸,次氯酸无法制盐酸 |
| B、Ca(OH)2能制成澄清石灰水,次氯酸无法制盐酸 |
| C、KNO3的溶解度大,用重结晶法除去KNO3中混有的NaCl |
| D、BaSO4难溶于酸,用盐酸和BaCl2溶液检验SO42- |


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用25ml量筒量取18.65ml水 |
| B、用广泛pH试纸测得某溶液的pH为5 |
| C、称取10.1gNaOH时,取出标定为10g的砝码放在右盘上,并将游码右移到0.1g的位置 |
| D、用250ml容量瓶配制100mlNaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
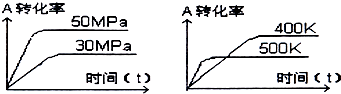 如图表示可逆反应mA(g)+nB(s)?xC(g)在不同温度和压强下,反应物A的转化率变化情况.下列判断正确的是( )
如图表示可逆反应mA(g)+nB(s)?xC(g)在不同温度和压强下,反应物A的转化率变化情况.下列判断正确的是( )| A、m>x,正反应为放热反应 |
| B、m+n<x,正反应为吸热反应 |
| C、m<x,正反应为放热反应 |
| D、m>x,正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、潮湿疏松透气的土壤中 |
| B、含铁元素较多的酸性土壤中 |
| C、干燥致密不透气的土壤中 |
| D、含碳量较高,潮湿透气的中性土壤中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 甲烷 | 氨气 | 水 | 硫化氢 |
| 偶极矩(μ)/德拜尔 | 0 | 1.66 | 1.85 | 1.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
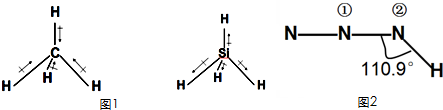
 意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知N-N键能167kJ?mol-1N≡N键能942kJ?mol-1.根据以上信息和数据,能判断且说法正确的是( )
意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知N-N键能167kJ?mol-1N≡N键能942kJ?mol-1.根据以上信息和数据,能判断且说法正确的是( )| A、N4属于一种新型的化合物 |
| B、N4与N2互为同素异形体 |
| C、N4比P4(白磷)更稳定 |
| D、N4气体转变为N2将吸收能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com