
| 物质 | 甲烷 | 氨气 | 水 | 硫化氢 |
| 偶极矩(μ)/德拜尔 | 0 | 1.66 | 1.85 | 1.1 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、较强酸可制较弱酸,次氯酸无法制盐酸 |
| B、Ca(OH)2能制成澄清石灰水,次氯酸无法制盐酸 |
| C、KNO3的溶解度大,用重结晶法除去KNO3中混有的NaCl |
| D、BaSO4难溶于酸,用盐酸和BaCl2溶液检验SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热NH4Cl晶体制备氨气 |
| B、将蘸有浓氨水和浓硝酸的玻璃棒靠近,观察到白烟 |
| C、将氨水缓慢滴入AlCl3溶液中,研究Al(OH)3的两性 |
| D、室温下测定等浓度氨水和NaOH溶液的pH,比较N和Na的金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应速率可用一定时间内任何一种反应物浓度的减小或生成物浓度的增加来表示 |
| B、化学反应速率0.8mol?L-1?s-1是指1s时某物质的浓度为0.8mol?L-1 |
| C、根据化学反应速率可以知道化学反应进行的快慢 |
| D、对于任何化学反应来说,反应速率越大,反应现象就越明显 |
查看答案和解析>>
科目:高中化学 来源: 题型:
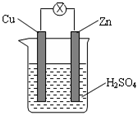
| A、锌片为负极,发生还原反应 |
| B、电流从锌片流向铜片 |
| C、一段时间后,铜片质量减轻 |
| D、一段时间后,溶液pH值变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.8L 0.4mol/L的NaOH溶液 |
| B、0.1L 0.5mol/L的NaCl溶液 |
| C、1L 0.3mol/L的NaCl溶液 |
| D、0.2L0.25mol/L的Na3PO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com