


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 |
| B、向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
| C、向氯水中加入紫色石蕊试液,先变红后褪色,说明氯水中含有H+及HClO |
| D、向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中只含有HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用25ml量筒量取18.65ml水 |
| B、用广泛pH试纸测得某溶液的pH为5 |
| C、称取10.1gNaOH时,取出标定为10g的砝码放在右盘上,并将游码右移到0.1g的位置 |
| D、用250ml容量瓶配制100mlNaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、潮湿疏松透气的土壤中 |
| B、含铁元素较多的酸性土壤中 |
| C、干燥致密不透气的土壤中 |
| D、含碳量较高,潮湿透气的中性土壤中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 甲烷 | 氨气 | 水 | 硫化氢 |
| 偶极矩(μ)/德拜尔 | 0 | 1.66 | 1.85 | 1.1 |
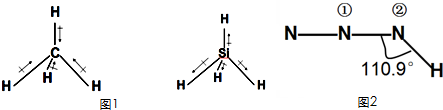
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com