
| n |
| V |


科目:高中化学 来源: 题型:
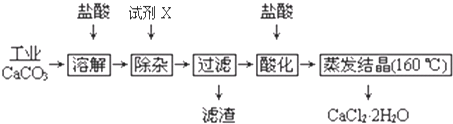
| 沉淀 | 开始沉淀时pH | 完全沉淀时pH | 开始溶解时pH |
| Fe(OH)3 | 2.3 | 3.7 | - |
| Al(OH)3 | 4.0 | 5.2 | 7.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
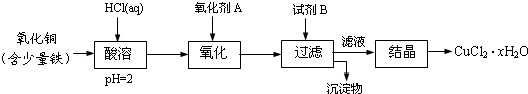
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 |
| B、向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
| C、向氯水中加入紫色石蕊试液,先变红后褪色,说明氯水中含有H+及HClO |
| D、向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中只含有HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
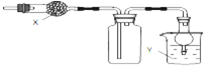
| A、X是碱石灰,收集到的气体是氯化氢,Y是水 |
| B、X是碱石灰,收集到的气体是氨气,Y是水 |
| C、X是氯化钙,搜集到的气体是二氧化硫,Y是氢氧化钠 |
| D、X是氯化钙,收集到的气体是一氧化氮,Y是氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 甲烷 | 氨气 | 水 | 硫化氢 |
| 偶极矩(μ)/德拜尔 | 0 | 1.66 | 1.85 | 1.1 |
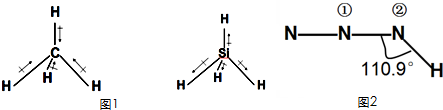
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com