
| 0.005mol |
| 0.5L |
| Kw |
| 0.01 |
| Ksp |
| c(0H -) 2 |
| 1.8×10 -11 |
| 0.12 |


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
| A、75%(体积分数)的酒精溶液常用于医疗消毒 |
| B、乙烯主要用于作燃料使用 |
| C、石油裂化的主要目的是为了得到轻质油 |
| D、乙酸常用作调味剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
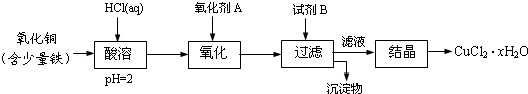
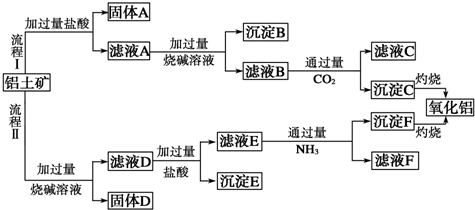
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 |
| B、向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
| C、向氯水中加入紫色石蕊试液,先变红后褪色,说明氯水中含有H+及HClO |
| D、向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中只含有HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、潮湿疏松透气的土壤中 |
| B、含铁元素较多的酸性土壤中 |
| C、干燥致密不透气的土壤中 |
| D、含碳量较高,潮湿透气的中性土壤中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com