
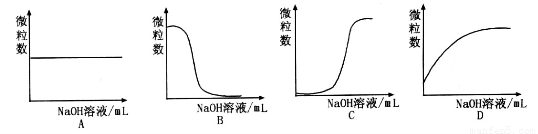
已知HA是一种弱酸。请回答下列问题:
(1)现有一种含有HA和其钠盐NaA的溶液。
①组成该溶液的微观粒子有?????????? ;
②若向该溶液中加入少量盐酸时,发生反应的离子方程式是????????????????????? ;
③若向该溶液中逐滴加入NaOH溶液时,下列图像能表示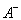 离子数目变化趋势的是???????? (填字母)。
离子数目变化趋势的是???????? (填字母)。
(2)现将1体积0.04mol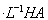 溶液和1体积0.02mol
溶液和1体积0.02mol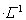 NaOH溶液混合,得到2体积混合溶液。
NaOH溶液混合,得到2体积混合溶液。
①若该混合液显碱性,则其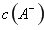 ??????????? 0.01 mol
??????????? 0.01 mol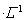 (填“<”、“=”或“>”);
(填“<”、“=”或“>”);
②若该混合液显酸性,则溶液中所有离子的浓度由大到小的顺序是?????????? 。
(1)①H2O、HA、H+、Na+、OH?、A-(2分,有错不得分)
②A-+H+ HA(2分,不写可逆号也可)
HA(2分,不写可逆号也可)
③D(1分)
(2)①<(1分)
②c(A-)>c(Na+)>c(H+)>c(OH?)(2分)
【解析】
试题分析:(1)①溶液中的微观粒子既包括离子,也包括分子,所以含有HA和其钠盐NaA的溶液的微观粒子有:H2O、HA、H+、Na+、OH?、A-
②加入少量盐酸,HCl与NaA反应生成HA,所以离子方程式为:A-+H+ HA
HA
③溶液含有HA和NaA,逐滴加入NaOH溶液,HA与NaOH反应生成NaA和H2O,所以A2-数目逐渐增大,故D项正确。
(2)①1体积0.04mol/LHA溶液和1体积0.02mol/LNaOH溶液混合,HA过量,得到等量的NaA和HA,若该混合液显碱性,则c(H+)<c(OH?),根据电荷守恒c(H+)+c(Na+)=c(OH?)+c(A-)可得c(A-)<0.01mol?L?1。
②若该混合液显酸性,则HA的电离程度大于NaA的水解程度,溶液中所有离子的浓度由大到小的顺序是:c(A-)>c(Na+)>c(H+)>c(OH?)
考点:本题考查盐类的水解、弱电解质的电离、离子浓度比较。


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
 Ⅰ常温下,向100mL0.01mol?L-1HA溶液中逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
Ⅰ常温下,向100mL0.01mol?L-1HA溶液中逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:| 溶质 | CH3COONa | NaHCO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:宜春模拟 题型:填空题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com