
| A、饱和氯水中 Cl-、NO3-、Na+、SO32- |
| B、强酸性的溶液中 C6H5O-、K+、SO42-、Br- |
| C、Na2S溶液中 SO42-、K+、Cl-、Cu2+ |
| D、强碱性的溶液中 NO3-、I-、Na+、AlO2- |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱物质的量相等 |
| B、在酸、碱中和滴终点时不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量溶液进行调整 |
| C、配制0.1mol/L的盐酸500ml,应选用的仪器有:胶头滴管、烧杯、玻璃棒、天平、500ml容量瓶 |
| D、将食用盐溶于水,然后滴入淀粉溶液,来检验食盐是否是加碘食盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、聚乙烯 | B、聚丁二烯 |
| C、聚苯乙烯 | D、聚乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
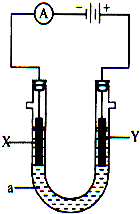 电解原理在化学工业中有广泛应用.如图示,是一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图示,是一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向漂白粉中加入稀盐酸,有无色无味气体产生,则说明漂白粉已变质 |
| B、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| C、溶液里加入盐酸,有能使澄清石灰水变浑浊的无色无味的气体生成,则说明溶液中一定含有HCO3- |
| D、溶液中加入稀硝酸后,再加少量AgNO3溶液,有白色沉淀生成,则溶液中含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| B、1.0mol/L NH4Cl溶液:c(NH4+)=c(Cl-) |
| C、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向该溶液中加入KI溶液后,原有的5种离子的物质的量不变 |
| B、向该溶液中滴加稀NaOH溶液,立即出现白色沉淀 |
| C、向该溶液中加入过量铁粉,只发生置换反应 |
| D、若溶液中c (Cl-)=0.6mol/L,则该溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、此时正反应速率一定大于逆反应速率 |
| B、反应一定放出热量 |
| C、平衡时反应物的浓度一定降低 |
| D、平衡时生成物的质量分数一定增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com