
| A. | S在过量的O2中充分燃烧,可得SO3 | |
| B. | 除去在Na2CO3固体中混有的NaHCO3的最好办法是通入过量的CO2 | |
| C. | 鉴别NaHCO3溶液与Na2CO3溶液,可用澄清的石灰水 | |
| D. | 等物质的量的Na2CO3和NaHCO3与盐酸反应,消耗HCl的物质的量之比为2:1 |
分析 A.S在过量的O2中燃烧生成二氧化硫;
B.碳酸氢钠不稳定,加热易分解;
C.二者都与石灰水反应生成沉淀;
D.NaHCO3和Na2CO3都与盐酸反应生成二氧化碳气体:Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2,结合方程式计算.
解答 解:A.S在过量的O2中燃烧生成二氧化硫,不能生成三氧化硫,二氧化硫在催化作用下可生成三氧化硫,故A错误;
B.碳酸氢钠不稳定,加热易分解,应用加热的方法除杂,故B错误;
C.二者都与石灰水反应生成沉淀,应加入氯化钙鉴别,故C错误;
D.NaHCO3和Na2CO3都与盐酸反应生成二氧化碳气体:Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2,等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,放出CO2体积相等,消耗HCl的物质的量之比为2:1,故D正确.
故选D.
点评 本题综合考查元素化合物知识,为高考常见题型,侧重于学生的分析能力、实验能力的考查,注意把握物质的性质的异同以及实验的严密性、可行性的评价,难度不大.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:解答题
| H2CO3 | K${\;}_{{\;}_{{a}_{1}}}$=4.3×10-7 | HClO | Ka=2.95×10-8 |
| K${\;}_{{a}_{2}}$=5.61×10-11 | AgCl | Ksp=1.77×10-10 | |
| CH3COOH | Ka=1.76×10-5 | Ag2CrO4 | Ksp=1.12×10-12 |
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| FeCl3溶液体积/mL | 100 | 100 | 100 | 100 |
| 加入粉末质量/g | 3 | 6.6 | 9 | 12 |
| 剩余粉末质量/g | 0 | 0.64 | 3.2 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | |||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ | ||||
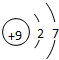 ;最高价氧化物对应的水化物中碱性最强的是NaOH(填化学式)
;最高价氧化物对应的水化物中碱性最强的是NaOH(填化学式)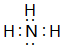 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
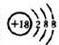 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,71gCl2和22.4LHCl | B. | 相同质量的氢气和氮气 | ||
| C. | 在0℃时,1体积的O2和1体积的HCl | D. | 相同体积的CO2和 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应中反应物的总焓大于生成物的总焓 | |
| B. | 原子组成分子一定放出热量 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 化石燃料在地球上的蕴藏量是有限的,而且又都是经过亿万年才能形成的非再生资源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠保存在煤油中 | |
| B. | 试剂瓶中的液溴可用水封存,防止溴挥发 | |
| C. | 保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉 | |
| D. | 浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com