
| A. | 少量金属钠保存在煤油中 | |
| B. | 试剂瓶中的液溴可用水封存,防止溴挥发 | |
| C. | 保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉 | |
| D. | 浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处 |
分析 A.钠易与空气中的氧气、水反应,与煤油不反应;
B.溴单质易挥发,溴的密度比水大,可用水封存;
C.硫酸亚铁易被氧化为硫酸铁;
D.浓硝酸有强氧化性,会腐蚀橡胶塞.
解答 解:A.钠易与空气中的氧气、水等反应,与煤油不反应,且密度比煤油大,可保存在煤油中,故A正确;
B.溴单质易挥发,溴的密度比水大,溴微溶于水.为防止液溴挥发,所以用水密封,故B正确;
C.硫酸亚铁易被氧化为硫酸铁,常加入少量铁粉防止亚铁离子被氧化,加入硫酸防止其水解,故C正确;
D.浓硝酸见光易分解,需避光保存,用棕色瓶盛放,贮存在阴凉处,浓硝酸有强氧化性,会腐蚀橡胶塞,故D错误.
故选D.
点评 本题考查较为综合,涉及药瓶的保存,侧重于学生的分析能力和实验能力的考查,为高频考点,注意药品的保存取决于物质的性质,学习中注意相关基础知识的积累,难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:填空题
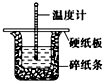 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S在过量的O2中充分燃烧,可得SO3 | |
| B. | 除去在Na2CO3固体中混有的NaHCO3的最好办法是通入过量的CO2 | |
| C. | 鉴别NaHCO3溶液与Na2CO3溶液,可用澄清的石灰水 | |
| D. | 等物质的量的Na2CO3和NaHCO3与盐酸反应,消耗HCl的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY2一定能与水反应 | B. | X可能是ⅣA、VA或ⅥA族元素 | ||
| C. | 符合要求的XY2物质有两种 | D. | X、Y一定不是同一主族的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol | B. | 0.1mol | C. | 2mol | D. | 1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液:Fe3+、K+、Cl-、SO42- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1mol/LNaAlO2溶液:H+、Na+、Cl-、SO42- | |
| D. | 与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
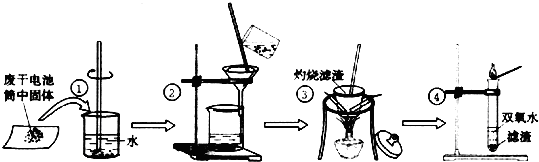
| 实验目的 | 操作 | 实验现象 | 结论 |
| 1.检验Cl- | 取少许滤液于试管中,加入硝酸酸化的硝酸银溶液 | 产生白色沉淀 | 含有Cl- |
| 2.检验NH4+ | 取少许滤液于试管中,加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近 | 石蕊试纸变蓝色 | 含有NH4+ k |
| 3.检验Zn2+ | 取少许滤液于试管中,加入稀氨水 | 先产生白色沉淀,继续加入氨水,沉淀又溶解 | 含有Zn2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com