
| ���� | HCOOH | HCN | H2CO3 |
| ����ƽ�ⳣ����25�棩 | K=1.77��10-4 | K=4.9��10-10 | K1=4.2��10-7 K2=5.6��10-11 |
 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д� ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���к͵�����������ʵ���Ũ�ȵ�����ʹ�����Һ�����������������ƶ��ڴ��� |
| B��������������Һ�Ͱ�ˮ��ϡ��һ�������ߵ�c(OH��)�����ٵ�ԭ����һ�� |
| C�������£�ij��Һ����ˮ�������c(OH��)��1��10��10 mol/L������Һ���������� |
| D�������������ʵ���Ũ���Ǵ�����������������c(H��)Ҳ�Ǵ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٣��ۣ��� | B���ۣ��٣��� | C���٣��ڣ��� | D���ڣ��ۣ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| �� | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6��10-5 | 6.3��10-9 | 1.6��10-9 | 4.2��10-10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
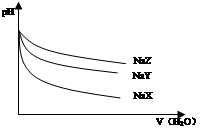
| A��������������ԭ��Һ�У�ˮ�ĵ���ȴ�С��NaX��NaY��NaZ |
| B���ڵ����ʵ���Ũ�ȵ�NaX��NaY��NaZ���Һ�У�����Ũ�ȵĴ�С��ϵ��c(Z��)��c(Y��)��c(X��) |
| C��������NaX��NaY�Ļ��Һ�д���c(HX)/c(X��)=c(HY)/c(Y��) |
| D����0.2mol��L��1 NaX��Һ�м�������0.1mol��L��1�����ᣬ���û��Һ�д���c(H��)��c(HX)=c(OH��)��c(Cl��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
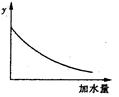
| A����Һ��pH | B������ĵ���ƽ�ⳣ�� |
| C����Һ�ĵ������� | D������ĵ���̶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ʵ���� | HA�����ʵ� ��Ũ��(mol��L-1) | NaOH�����ʵ� ��Ũ��(mol��L-1) | ��Ϻ��� Һ��pH |
| �� | 0.1 | 0.1 | pH=a |
| �� | 0.12 | 0.1 | pH=7 |
| �� | 0.2 | 0.1 | pH>7 |
| �� | 0.1 | 0.1 | pH=10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
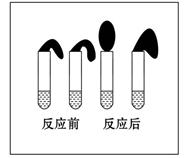
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������£�pH��ͬ��CH3COOH��Һ��HCN��Һ�ֱ��ˮϡ����ͬ�ı���ʱ��ǰ��pH�仯С |
| B�������£���Ũ�ȵ�CH3COONa��NaCN��ҺpH�����ߴ� |
| C��HCN��Һ��NaOH��Һ���������Ϻ�һ������C��H+���DC��OH-��=C��CN-���DC��Na+�� |
| D����Һ����ˮ�������C��H+����ǰ���Ǻ��ߵ�10m-n�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com