
【题目】根据如图所示转化关系,判断A、B、C、D各是什么物质,写出有关的化学方程式:
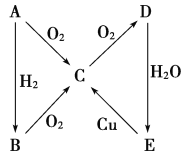
(1)当A为气体单质时,A是________,B是__________,C是________,D是________,E是________,E→C的化学方程式:_________________________________________________。
(2)当A为固体单质时,A是________,B是________,C是________,D是________,E是________,E→C的化学方程式是_______________________________________________。
【答案】N2 NH3 NO NO2 HNO3 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O S H2S SO2 SO3 H2SO4 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
【解析】
(1)当A是气体单质时,A能与氧气、氢气反应,且B能发生连续氧化反应,E能和Cu反应生成C,则E为硝酸,所以A是N2,B为NH3,C为NO,D为NO2,E为HNO3;据以上分析解答。
(2)如果A是固体单质,E为酸,能和Cu反应生成C,则E是硫酸, A是S,B是H2S,C是SO2,D是SO3, E是H2SO4;据此分析解答。
(1)当A是气体单质时,A能与氧气、氢气反应,且B能发生连续氧化反应,E能和Cu反应生成C,则E为硝酸,A为氮气,A和氢气反应生成B为氨气,A和氧气反应生成C为NO, NO被氧气氧化生成D为二氧化氮,二氧化氮和水反应生成硝酸E,所以当A为气体单质时,A是N2,B为NH3,C为NO,D为NO2,E为HNO3;稀硝酸和铜反应生成一氧化氮、硝酸铜和水,E→C的化学方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
综上所述,本题答案是:N2,NH3,NO,NO2,HNO3;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(2)如果A是固体单质,E为酸,能和Cu反应生成C,则E是浓硫酸,则A为S,A和氢气反应生成B为H2S,A和氧气反应生成C为SO2,C被氧气氧化生成D为SO3;当A为固体单质时,A是S,B是H2S,C是SO2,D是SO3, E是H2SO4;浓硫酸和铜加热反应生成硫酸铜、二氧化硫和水,E→C的化学方程式:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
综上所述,本题答案是:S, H2S, SO2, SO3, H2SO4;Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】工业上,常采用氧化还原方法处理尾气中的CO、NO。
(氧化处理法)沥青混凝土可作为反应:2CO(g)+O2(g)![]() 2CO2(g)的催化剂。
2CO2(g)的催化剂。
图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
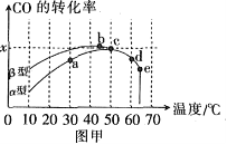
(1)在a、b、c、d四点中,未达到平衡状态的是___。
(2)已知c点时容器中O2浓度为0.04mol·L-1,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=___(用含x的代数式表示)。
(3)下列关于图甲的说法正确的是__。
A.CO转化反应的平衡常数K(a)<K(c)
B.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大
C.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高
D.e点转化率出现突变的原因可能是温度升高后催化剂失去活性
(还原处理法)某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(含0.025molNO、0.5molO2和足量碳烟)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据,结果如图乙所示。
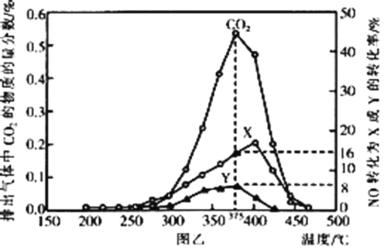
(4)375℃时,测得排出的气体中含0.45molO2和0.052molCO2,则Y的化学式为___。
(5)实验过程中采用NO模拟NOx,而不采用NO2的原因是___。
(6)工业上常用高浓度的K2CO3溶液吸收CO2,再利用电解法使K2CO3溶液再生,其装置示意图如图:
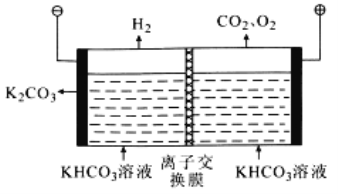
①在阳极区发生的反应包括___和H++HCO3- =CO2↑+H2O
②简述CO32-在阴极区再生的原理:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是石蜡油在炽热碎瓷片的作用下产生乙烯并检验乙烯性质的实验,请回答下列问题:

(1)A中碎瓷片的作用是________。
(2)B装置中反应的化学方程式为__________。
(3)C装置中可观察到的现象是_________。
(4)查阅资料.乙烯与酸性高锰酸钾溶液反应产生二氧化碳,根据本实验中装置_____(填装置字母)中的实验现象可判断该资料是否直实。
(5)通过上述实验探究,检验甲烷和乙烯的方法是_______(填字母,下同),除去甲烷中乙烯的方法是___。
A 气体通入水中 B 气体通过盛溴水的洗气瓶
C 气体通过盛酸性高锰酸钾溶液的洗气瓶 D 气体通过氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚硫酸钠晶体与浓硫酸反应可以产生二氧化硫,按下图进行演示实验。
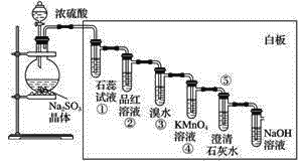
请回答下列问题:
(1)①中的实验现象是__________,说明二氧化硫具有的性质是__________。
(2)②中的实验现象是__________,证明二氧化硫有___________性。
(3)③中的实验现象是_______________,证明二氧化硫有____________性。
(4)④中的实验现象是__________,证明二氧化硫有______性。
(5)⑤中的实验现象是_____________,说明二氧化硫具有的性质是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上较早冶炼锌的国家。在现代工业中,锌更是在电池制造、合金生产等领域有着广泛的用途。
已知:锌的熔点为419.6℃,沸点907℃。
I.图是古代以炉甘石(ZnCO3)为原料炼锌的示意图。
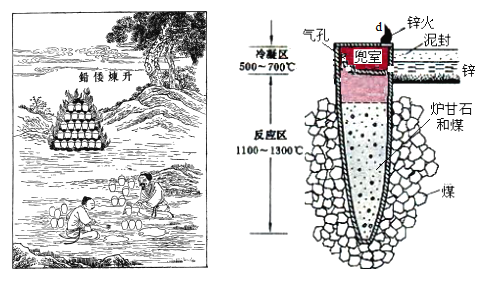
(1)泥罐内的主要反应为:
i.ZnCO3(s) = ZnO(s) + CO2(g) H1
ii.CO2(g) + C(s) = 2CO(g) H 2
……
总反应:ZnCO3(s) + 2C(s) = Zn(g) + 3CO(g) H3
利用H1和H 2计算时H3,还需要利用_________反应的H。
(2)泥罐中,金属锌的状态变化是_____;d口出去的物质主要是_______。
Ⅱ.现代冶炼锌主要采取湿法工艺。以闪锌矿(主要成分为ZnS,还含铁等元素)、软锰矿(主要成分为MnO2,还含铁等元素)为原料联合生产锌和高纯度二氧化锰的一种工艺的主要流程如下:
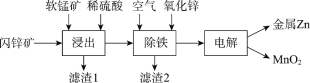
(3)浸出:加入FeSO4能促进ZnS的溶解,提高锌的浸出率,同时生成硫单质。Fe2+的作用类似催化剂,“催化”过程可表示为:
ⅰ:MnO2+2Fe2++4H+ =Mn2++2Fe3++2H2O
ⅱ:……
① 写出ⅱ的离子方程式:_________。
② 下列实验方案可证实上述“催化”过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量MnO2,溶液变红。
b.________。
(4)除铁:已知①进入除铁工艺的溶液的pH约为3;②控制溶液pH为2.5~3.5,使铁主要以FeOOH沉淀的形式除去。结合离子方程式说明,通入空气需同时补充适量ZnO的理由是_________。
(5)电解:用惰性电极电解时,阳极的电极反应是______。
(6)电解后的溶液中可循环利用的物质是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为用惰性电极电解制备高锰酸钾的装置示意图如下。下列说法正确的是
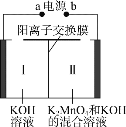
A.a为电源正极
B.Ⅰ中的K+通过阳离子交换膜移向Ⅱ
C.若不使用离子交换膜,KMnO4的产率可能会降低
D.若阴极产生0.2 mol气体,理论上可得到0.2 mol KMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸中二氧化硫的催化氧化原理为:2SO2(g)+O2(g)![]() 2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是

A. 在A、B、C三点时,V(正)=v(逆),在D点时V(正)>v(逆)
B. A、B、C三点的平衡常数一定不相同
C. 升高温度可以加快化学反应速率,有利于平衡向正反应方向移动
D. 一定温度下,保持容器体积不变,向平衡体系中通人稀有气体,压强增大,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组通过分析镁与酸反应时pH的变化,探究镁与醋酸溶液反应的实质。
(实验)在常温水浴条件下,进行实验Ⅰ~Ⅲ,记录生成气体体积和溶液pH的变化:
Ⅰ.取0.1 g光亮的镁屑(过量)放入10 mL 0.10 mol·L–1 HCl溶液中;
Ⅱ.取0.1 g光亮的镁屑放入10 mL 0.10 mol·L–1 CH3COOH溶液(pH = 2.9)中;
Ⅲ.取0.1 g光亮的镁屑放入10 mL pH = 2.9 HCl溶液中。
(数据)
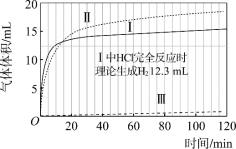
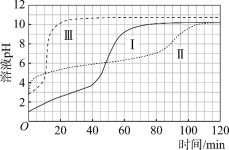
图1 图2
(1)起始阶段,Ⅰ中主要反应的离子方程式是____。
(2)Ⅱ起始溶液中![]() 约为____。(选填“1”、“10”或“102”)
约为____。(选填“1”、“10”或“102”)
(3)起始阶段,导致Ⅱ、Ⅲ气体产生速率差异的主要因素不是c(H+),实验证据是____。
(4)探究Ⅱ的反应速率大于Ⅲ的原因。
提出假设:CH3COOH能直接与Mg反应。
进行实验Ⅳ:____。
得出结论:该假设成立。
(5)探究醋酸溶液中与Mg反应的主要微粒,进行实验Ⅴ。
与Ⅱ相同的条件和试剂用量,将溶液换成含0.10 mol·L–1的 CH3COOH与0.10 mol·L–1 CH3COONa的混合溶液(pH = 4.8),气体产生速率与Ⅱ对比如下。
a.实验Ⅴ起始速率 | b.实验Ⅱ起始速率 | c.实验ⅡpH=4.8时速率 |
2.1 mL·min–1 | 2.3 mL·min–1 | 0.8 mL·min–1 |
对比a~c中的微粒浓度,解释其a与b、a与c气体产生速率差异的原因:____。
(6)综合以上实验得出结论:
①镁与醋酸溶液反应时,CH3COOH、H+、H2O均能与镁反应产生氢气;
②____。
(7)实验反思:120 min附近,Ⅰ~ⅢpH均基本不变,pH(Ⅰ) ≈ pH(Ⅱ) < pH(Ⅲ),解释其原因:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员采用双极膜将酸-碱电解液隔离,实现MnO2/Mn2+和Zn/![]() 的两个溶解/沉积电极氧化还原反应,研制出新型高比能液流电池,其放电过程原理示意图如下:
的两个溶解/沉积电极氧化还原反应,研制出新型高比能液流电池,其放电过程原理示意图如下:
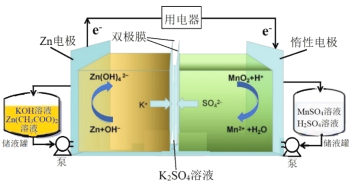
下列说法不正确的是
A.放电过程中,总反应方程式为Zn+MnO2+4OH-+4H+===![]() +Mn2++2H2O
+Mn2++2H2O
B.放电过程中,当1molZn参与反应时,理论上有4molK+发生迁移
C.充电过程中,阴极的电极反应为![]() +2e-===Zn+4OH-
+2e-===Zn+4OH-
D.充电过程中,右侧池中溶液pH逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com