
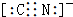 ��
������ ��1��Na��K�ܺ�ˮ��Ӧ������������������ȼ�����ɹ�������������ƺ�ˮ��������̼��Ӧ�������������ٽ��ơ���ȼ�գ�
��2��������ԭ��Ӧ���л��ϼ����ߵ�Ԫ��Ҳ�л��ϼ۽��͵�Ԫ�أ�
��3�����������֪��˫��ˮ���軯�Ʒ�Ӧ����NH3��NaHCO3������������ԭ��Ӧ��ƽ��
��4��CN-�и�ԭ�Ӿ�����8�����ȶ��ṹ�������������
��5��NaCN����ǿ�������Σ�����Һ��ˮ���Լ��ԣ�Kh=$\frac{Kw}{Ka}$���ݴ˼��㣻��0.2 mol•L-1 HCN��Һ��0.1 mol•L-1��NaOH��Һ�������Ϻ�������Һ��c��HCN��=0.05 mol•L-1��c��NaCN��=0.05 mol•L-1�����ڻ�Ϻ���Һ�ʼ��ԣ�˵��NaCNˮ��̶ȴ���HCN�ĵ���̶ȣ���ϵ���غ�������غ�����⣻
��6������������1m3�÷�ˮ��CN-ת��Ϊ��������Ⱦ���壬Ӧ���ɶ�����̼�͵�������Ϸ���ʽ���㣮
��� �⣺��1��Na��K�ܺ�ˮ��Ӧ������������������ȼ�����ɹ�������������ƺ�ˮ��������̼��Ӧ�������������ٽ��ơ���ȼ�գ�����Ӧ�ò���ϸɳ���
�ʴ�Ϊ��C��
��2��������ԭ��Ӧ���л��ϼ����ߵ�Ԫ��Ҳ�л��ϼ۽��͵�Ԫ�أ�
A��NH4NO3��N2+O2+H2O��NԪ�ػ��ϼ۽��͡�OԪ�ػ��ϼ����ߣ�����������ԭ��Ӧ����A��ѡ��
B��NH4NO3��O2+HNO3+H2O��NԪ�ػ��ϼ����ߡ�OԪ�ػ��ϼ����ߣ�������������ԭ��Ӧ����Bѡ��
C��NH4NO3��N2+HNO3+H2O��NԪ���л��ϼ����ߵ�Ҳ�л��ϼ۽��͵ģ�����������ԭ��Ӧ����C��ѡ��
D��NH4NO3��N2O+H2O��NԪ���л��ϼ����ߵ�Ҳ�л��ϼ۽��͵ģ�����������ԭ��Ӧ����D��ѡ��
�ʴ�Ϊ��B��
��3�����������֪��˫��ˮ���軯�Ʒ�Ӧ����NH3��NaHCO3���䷴Ӧ�ķ���ʽΪ��NaCN+H2O2+H2O=NaHCO3+NH3����
�ʴ�Ϊ��NaCN+H2O2+H2O=NaHCO3+NH3����
��4��CN-�и�ԭ�Ӿ�����8�����ȶ��ṹ����������������Ե���ʽΪ��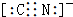 ��
��
�ʴ�Ϊ��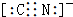 ��
��
��5��NaCN����ǿ�������Σ�����Һ��ˮ���Լ��ԣ���ˮ������ӷ���ʽΪ��CN-+H2O?HCN+OH-��Kh=$\frac{Kw}{Ka}$=$\frac{1{0}^{-14}}{4.9��1{0}^{-10}}$��2.0��l0-5��
A����Ϻ����Һ��c��HCN��=0.05 mol•L-1��c��NaCN��=0.05 mol•L-1����Һ�ʼ��ԣ�˵��NaCNˮ��̶ȴ���HCN�ĵ���̶ȣ���c��HCN����c��CN-������A����
B���ݵ���غ��֪c��H+��+c��Na+��=c��CN-��+c��OH-������Һ�Լ��ԣ���c��OH-����c��H+������c ��Na+����c ��CN-������B��ȷ��
C���������غ��֪c��HCN��+c��CN-��=2c��Na+�����־ݵ���غ��֪c��H+��+c��Na+��=c��CN-��+c��OH-����������ʽ�ɵ�2c��H+��+c��HCN��+c��CN-��=2c��CN-��+2c��OH-������2c��H+��+c��HCN��=c��CN-��+2c��OH-����c��HCN��-c��CN-��=2c��OH-��-2c��H+������C����
D���������غ��֪c��HCN��+c��CN-��=0.1mol•L-1����D����
�ʴ�Ϊ��CN-+H2O?HCN+OH-��2.0��l0-5��B��
��6����Ӧ�ķ���ʽΪ��2KCN+5Cl2+4H2O=2KCl+8HCl+N2+2CO2����ˮ��CN-Ũ��Ϊ26mg•L-1��1m3�÷�ˮ��n��CN-��=$\frac{1000L��26mg/L��1{0}^{-3}g/mg}{26g/mol}$=1mol��
����Ҫ2.5mol���������Ϊ2.5mol��22.4L/mol=56L��
�ʴ�Ϊ��56��
���� �����ۺϿ�����������ԭ��Ӧ��������ʵĵ���ƽ�⣬�漰������ԭ��Ӧ�Ļ������������ԭ��Ӧ����ʽ��ƽ��������ʵĵ���ƽ���ƽ�ⳣ���ļ��㡢�������ʵ�֪ʶ�㣬ע��NaCN��C��NԪ�ػ��ϼ۷ֱ���+2�ۡ�-3�ۣ�Ϊ�״��㣬��Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����������
���������� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

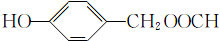
 ��RCN$\stackrel{H_{2}O/H+}{��}$RCOOH��RCOOH$\stackrel{SOCl_{2}}{��}$RCOCl$\stackrel{R'OH}{��}$RCOOR��
��RCN$\stackrel{H_{2}O/H+}{��}$RCOOH��RCOOH$\stackrel{SOCl_{2}}{��}$RCOCl$\stackrel{R'OH}{��}$RCOOR��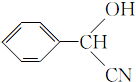 ��
�� ��
�� ����ṹ��ʽ����
����ṹ��ʽ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
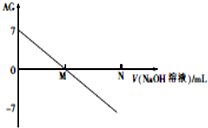 Ϊ�˸��õر�ʾ��Һ������ԣ���ѧ���������ȣ�aciditygrade���ĸ������AG=lg$\frac{c��{H}^{+}��}{c��O{H}^{-}��}$����������0.01mol•L-1������������Һ�ζ�20.00mL0.01mol•L-1 ���ᣬ�ζ������ͼ��ʾ�������й���������ȷ���ǣ�������
Ϊ�˸��õر�ʾ��Һ������ԣ���ѧ���������ȣ�aciditygrade���ĸ������AG=lg$\frac{c��{H}^{+}��}{c��O{H}^{-}��}$����������0.01mol•L-1������������Һ�ζ�20.00mL0.01mol•L-1 ���ᣬ�ζ������ͼ��ʾ�������й���������ȷ���ǣ�������| A�� | �����£�����ĵ���ƽ�ⳣ��ԼΪ10-6 | |
| B�� | M�����NaOH��Һ���������20.00mL | |
| C�� | M��ʱ��Һ�У�c��CH3COO-��=c��Na+�� | |
| D�� | ��N��ʱ����NaOH��Һ�����Ϊ40mL����N��ʱ��Һ�У�c��Na+��=2[c��CH3COO-��+c��CH3COOH��] |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ͼ�ǵ��CuCl2��Һ��װ�ã�����c��dΪʯī�缫��
��ͼ�ǵ��CuCl2��Һ��װ�ã�����c��dΪʯī�缫���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
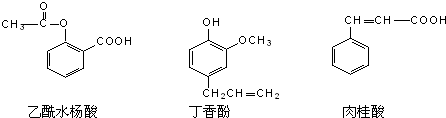
| A�� | �٢� | B�� | �ۢ� | C�� | �٢ۢ� | D�� | �٢ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
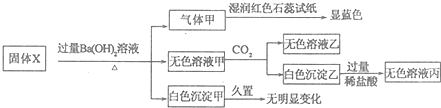
| A�� | ��ɫ�����Ҳ�һ����Al��OH��3 | B�� | �����һ���Ǵ����� | ||
| C�� | ����X��һ�����ڣ�NH4��2SO4��MgCl2 | D�� | ����X��һ������FeCl2��AlCl3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ȩ��ͪ�Dz�ͬ���ͬ���칹�壬���ߵĻ�ѧ�������� | |
| B�� | �ܷ���������Ӧ��������ȩ��1molȩ��������Һ��Ӧֻ�ܻ�ԭ��2mol Ag | |
| C�� | ȩ�������ܷ���������Ӧ�����ܷ�����ԭ��Ӧ | |
| D�� | ��ȩ����ͪ����������������ڴ��������·����ӳɷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��FeCl3��Һ��ʴͭ��·�壺Fe3++Cu�TFe2++Cu2+ | |
| B�� | ˮ�����м���ϡ���Na2SiO3+2H+�TH2SiO3��+2Na+ | |
| C�� | ���Ȼ�����Һ�еμӹ����İ�ˮ��Al3++3 OH-�TAl ��OH��3�� | |
| D�� | ����ʯ�����ᷴӦ��CaCO3+2H+�TCa2++H2O+CO2�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com