
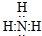 ;过氧化钠
;过氧化钠 .
.分析 (1)根据物质的构成微粒和微粒之间的作用力分析;
(2)氨气中存在3个氮氢键,氮原子最外层8个电子;过氧化钠中两个钠离子与过氧根离子通过离子键结合,两个氧原子通过共用1对电子结合;
(3)有新物质生成的变化属于化学变化;
(4)氢气与氯气反应生成HCl,属于放热反应;
(5)根据氯水的组成分析.
解答 解:(1)稀有气体属于单原子分子,分子中没有共价键,所以氖气中没化学键;氯化铵中铵根离子与氯离子之间形成离子键,铵根离子内存在N-H共价键,所以氯化铵中存在离子键和共价键;
故答案为:②;共价键和离子键;
(2)氨气中存在3个氮氢键,氮原子最外层8个电子,氨气的电子式为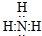 ;Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为
;Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ;
;
故答案为: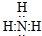 ;
; ;
;
(3)有新物质生成的变化属于化学变化,所以石墨转化成金刚石属于化学变化;
故答案为:化学;有新物质金刚石生成;
(4)氢气和氯气反应过程中,断裂1molH2中的化学键消耗的能量为Q1,断裂1molCl2中的化学键消耗的能量为Q2,形成1molHCl中的化学键释放的能量为Q3,该反应属于放热反应,所以Q1+Q2<2Q3;
故答案为:<;
(5)已知氯水中存在下列平衡Cl2+H2O?HCl+HCl,HClO?H++ClO-,H2O?H++OH-,HCl在溶液中完全电离,HClO在溶液中部分电离,所以溶液中阴离子为:ClO-、Cl-、OH-;
故答案为:ClO-、Cl-、OH-.
点评 本题考查了化学键、电子式、化学变化、以化学反应中的能量变化、氯水的成分等,题目涉及的知识点较多,侧重于基础知识的考查,题目难度不大,注意相关知识的积累


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:多选题
| A. | 铜与硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 大理石溶解于硝酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 向NaAlO2溶液中通入足量的CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | Fe与稀HNO3反应:Fe+2H+═Fe2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的稳定性:甲>乙>丙 | |
| B. | 甲、丙两元素最高价氧化物对应水化物的酸性强弱:甲<丙 | |
| C. | 原子半径的大小:甲>乙 | |
| D. | 乙元素的族序数比甲元素的族序数大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 气体的颜色不再发生变化 | |
| B. | 容器内的压强不再发生变化 | |
| C. | 单位时间内,每断裂2mol H-I键,同时有1mol I-I键生成 | |
| D. | 单位时间内,每断裂1mol H-H键,同时有1mol I-I键生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
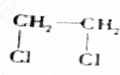 +2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaCl;
+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaCl;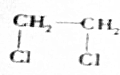 +2NaOH$→_{△}^{乙醇}$CH≡CH↑+2NaCl+2H2O;
+2NaOH$→_{△}^{乙醇}$CH≡CH↑+2NaCl+2H2O;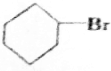 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$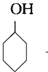 +NaBr;
+NaBr;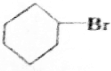 +NaOH$→_{△}^{C_{2}H_{5}OH}$
+NaOH$→_{△}^{C_{2}H_{5}OH}$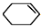 +H2O+NaBr.
+H2O+NaBr.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
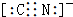 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com