
【题目】某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
装置 | 分别进行的操作 | 现象 |
| i. 连好装置一段时间后,向烧杯中滴加酚酞 | |
ii. 连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液 | 铁片表面产生蓝色沉淀 |
(1)小组同学认为以上两种检验方法,均能证明铁发生了吸氧腐蚀。
①实验i中的现象是________________________________。
②用化学用语解释实验i中的现象:________________________________。
(2)查阅资料:K3[Fe(CN)6]具有氧化性。
①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是_____________________。
②进行下列实验,在实验几分钟后的记录如下:
实验 | 滴管 | 试管 | 现象 |
| 0.5 mol·L-1K3[Fe(CN)6]溶液 | iii. 蒸馏水 | 无明显变化 |
iv. 1.0 mol·L-1NaCl溶液 | 铁片表面产生大量蓝色沉淀 | ||
v. 0.5 mol·L-1 Na2SO4溶液 | 无明显变化 |
a. 以上实验表明:在条件下____________,K3[Fe(CN)6]溶液可以与铁片发生反应。
b. 为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明Cl-的作用是____________________。
(3)有同学认为上述实验仍不严谨。为进一步探究K3[Fe(CN)6]的氧化性对实验ii结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是___________(填字母序号)。
实验 | 试剂 | 现象 |
A | 酸洗后的铁片、K3[Fe(CN)6]溶液(已除O2) | 产生蓝色沉淀 |
B | 酸洗后的铁片、K3[Fe(CN)6]和NaCl混合溶液(未除O2) | 产生蓝色沉淀 |
C | 铁片、K3[Fe(CN)6]和NaCl混合溶液(已除O2) | 产生蓝色沉淀 |
D | 铁片、K3[Fe(CN)6]和盐酸混合溶液(已除O2) | 产生蓝色沉淀 |
(4)综合以上实验分析,利用实验ii中试剂能证实铁发生了电化学腐蚀的实验方案是____________________________。
【答案】 碳棒附近溶液变红 O2 + 4e- + 2H2O = 4OH- K3[Fe(CN)6]可能氧化Fe生成Fe2+,会干扰由于电化学腐蚀负极生成Fe2+的检验 Cl-存在 Cl-破坏了铁片表面的氧化膜 AC 连好装置一段时间后,取铁片(负极)附近溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则说明负极附近溶液中产生了Fe2+,即发生了电化学腐蚀
【解析】(1)装置为铁的吸氧腐蚀,铁为负极,碳棒为正极,正极发生 O2+2H2O+4e-═4OH-,呈碱性,滴加酚酞,溶液变红。
①实验i中的现象是碳棒附近溶液变红,故答案为:碳棒附近溶液变红;
②用化学用语解释实验i中的现象:碳棒为正极,正极发生 O2+2H2O+4e-═4OH-,故答案为:O2+2H2O+4e-═4OH-;
(2)①可能为铁电极能直接和K3[Fe(CN)6]溶液发生氧化还原反应生成Fe2+,产生的Fe2+再与K3[Fe(CN)6]反应生成蓝色物质,故答案为:K3[Fe(CN)6]可能氧化Fe生成Fe2+,会干扰由于电化学腐蚀负极生成Fe2+的检验;
②a.由实验iii.蒸馏水,无明显变化;iv.1.0molL-1NaCl溶液,铁片表面产生大量蓝色沉淀;v.0.5molL-1Na2SO4溶液,无明显变化.可知在Cl-存在下,K3[Fe(CN)6]溶液可以与铁片发生反应,故答案为:Cl-存在;
b.由小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验III,发现铁片表面产生蓝色沉淀的实验可分析是Cl-破坏了铁表面的氧化膜,故答案为:Cl-破坏了铁表面的氧化膜;
(3)要验证K3[Fe(CN)6]具有氧化性,就要排除其它因素的影响,如:O2、铁表面的氧化膜等。A选项实验考虑了试剂中溶解的氧气和铁表面的氧化膜的影响,故A正确;B选项实验未考虑了试剂中溶解的氧气的影响,故B错误;C选项实验考虑了试剂中溶解的氧气和加入可能破坏铁表面的氧化膜的NaCl溶液,故C正确;D选项实验加入了盐酸和铁反应产生Fe2+,故D错误;故选AC;
(4)综合以上实验分析,利用实验ii中试剂能证实铁发生了电化学腐蚀的实验方案是:取出少许铁片(负极)附近的溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则说明负极附近溶液中产生了Fe2+,即发生了电化学腐蚀,故答案为:连好装置一段时间后,取铁片(负极)附近溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则说明负极附近溶液中产生了Fe2+,即发生了电化学腐蚀。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】纳米氧化钴在半导体和微电子行业应用广泛,某些金属废料中含有Co元素,从废料(含Co3O4、Al2O3、Li2O、Fe2O3等物质) 中制备高纯度的纳米级钴的氧化物,流程如下
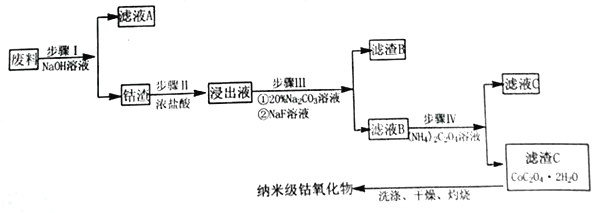
已知:
①LiF 难溶于水,Li2CO3微溶于水;
②钴元素常见的化合价为+2 和+3;
③部分金属离子形成氢氧化物沉淀的pH见下表。
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中发生的离子反应方程式_______________;
(2)步骤II加浓盐酸的作用是_______________;
(3)步骤III中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH的取值范围为_______________; 滤渣 B 的主要成分为_________________;
(4)简述如何检验滤液B中是否还有残留的Fe3+:_______________;
(5) 经过反复洗涤、干燥后称重,将质量为3.66gCoC2O4·2H2O进行灼烧,残留固体质量如图所示。
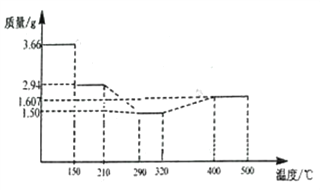
210℃~290℃时若生成两种气体,则发生反应的化学方程式为_______________,400℃~500℃所得固体的化学式为_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg—H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图实验装置,能得出相应实验结论的是
① | ② | ③ | 实验结论 |
| |
A | 浓醋酸 | CaCO3 | C6H5ONa | 酸性:醋酸>碳酸>苯酚 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | H2O | 电石 | KMnO4 | 乙炔具有还原性 | |
D | 盐酸 | Na2CO3 | Na2SiO3 | 非金属性:Cl>C>Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D为气体,其中A为黄绿色,D极易溶于水,形成的溶液可使酚酞变红,它们之间的转化关系如下图①所示:

(1)将气体B点燃,把导管伸入盛满气体A的集气瓶,反应过程中的实验现象有______________(填序号)
①放热 ②黄绿色褪去 ③瓶口有白雾 ④瓶口有白烟
⑤安静燃烧,发出黄色火焰 ⑥安静燃烧,发出苍白色火焰
(2)实验室制D的化学方程式为:_______________________________________。
(3)实验室可用如上图②所示装置收集D,下列叙述正确的是__________(填序号)
①D气体不能用排水法收集 ② 干燥管里盛有碱石灰
③ 图②中的a为棉花团,其作用是防止收集的气体逸出
(4)气体D催化氧化的化学方程式为:______________________________。
(5)物质E的化学式是_____________;E在下列物质分类中所属的物质种类是____________________________(填序号)。
①电解质 ②化合物 ③混合物 ④纯净物 ⑤非电解质 ⑥盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备氮化镁的装置示意图如下:

回答下列问题:
(1)检查装置气密性的方法是______________________,a的名称是_____________________。
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式___________________________________。
(3)C的作用是________________________,D的作用是________________,是否可以把C和D的位置对调并说明理由_________________________________。
(4)写出E中发生反应的化学方程式_____________________________________。
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有取之不尽的化学资源,从海水中可提取多种化工原料。如图是某工厂综合利用海水资源的示意图。

试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得饱和NaCl溶液。精制过程中所用试剂有a、BaCl2溶液、b、Na2CO3溶液、c、 NaOH溶液、d、盐酸。加入试剂顺序正确的是____________;
A、a.b.c.d B、c.b.a.d C、b.a.d.c D、a.c.b.d
(2)写出电解饱和食盐水方程式________________________________________,产生的Cl2和烧碱反应能生成____________(填商品名称),反应方程式________。
(3)海水中提取食盐后的母液中含有K+、Na+、Mg2+等。从离子反应的角度考虑,向母液中加入石灰乳的作用是_________________________。
(4)电解熔融的氯化镁所得的镁蒸气冷却后即为固体镁,可以冷却镁蒸气的气体氛围为_____。
A.H2 B.CO2 C.空气 D.Ar
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com