
【题目】纳米氧化钴在半导体和微电子行业应用广泛,某些金属废料中含有Co元素,从废料(含Co3O4、Al2O3、Li2O、Fe2O3等物质) 中制备高纯度的纳米级钴的氧化物,流程如下
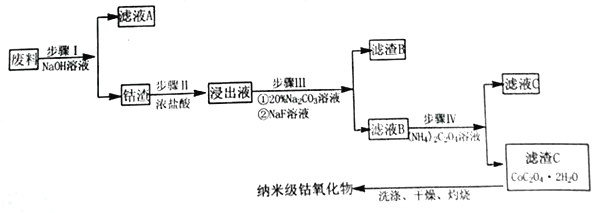
已知:
①LiF 难溶于水,Li2CO3微溶于水;
②钴元素常见的化合价为+2 和+3;
③部分金属离子形成氢氧化物沉淀的pH见下表。
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中发生的离子反应方程式_______________;
(2)步骤II加浓盐酸的作用是_______________;
(3)步骤III中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH的取值范围为_______________; 滤渣 B 的主要成分为_________________;
(4)简述如何检验滤液B中是否还有残留的Fe3+:_______________;
(5) 经过反复洗涤、干燥后称重,将质量为3.66gCoC2O4·2H2O进行灼烧,残留固体质量如图所示。
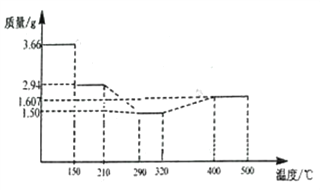
210℃~290℃时若生成两种气体,则发生反应的化学方程式为_______________,400℃~500℃所得固体的化学式为_______________;
【答案】 Al2O3+ 2OH-= 2AlO2-+ H2O 溶解Li2O、Fe2O3、并将Co3O4转化为Co2+,防止在后续除杂中将Co3+沉淀而造成损失 3.2≤pH<7.15 LiF、Fe(OH)3 取少量滤液B于试管中,向其中滴加KSCN溶液,观察溶液是否变红,若变红,则有Fe3+,反之则无Fe3+ CoC2O4![]() CoO+CO↑+CO2↑ Co3O4
CoO+CO↑+CO2↑ Co3O4
【解析】试题分析:本题以含Co3O4、Al2O3、Li2O、Fe2O3等物质的废料制备高纯度的纳米级钴的氧化物的流程为载体,考查流程的分析,方程式的书写,条件的控制,Fe3+的检验,热重图像的计算。步骤I向废料中加入NaOH溶液,废料中的Al2O3溶解得到滤液A,钴渣中主要成分为Co3O4、Li2O、Fe2O3等;由滤渣C逆推出滤液B中含Co2+,结合表中金属离子形成沉淀的pH,步骤II向钴渣中加入浓盐酸,Co3O4转化成CoCl2,Li2O转化成LiCl,Fe2O3转化成FeCl3;根据图示和已知①、③,步骤III中加入20%Na2CO3溶液的作用是除去Fe3+,加入NaF溶液的作用是除去Li+。
(1)步骤I中加入NaOH溶液,Al2O3与NaOH反应生成NaAlO2和H2O,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O。
(2)步骤II中加入浓盐酸发生反应:Co3O4+8HCl(浓)=3CoCl2+Cl2↑+4H2O、Li2O+2HCl=2LiCl+H2O、Fe2O3+6HCl=2FeCl3+3H2O,加入浓盐酸的作用是:溶解Li2O、Fe2O3、并将Co3O4转化为Co2+,防止在后续除杂中将Co3+沉淀而造成损失。
(3)步骤III中加入20%Na2CO3溶液的作用是除去Fe3+,根据金属离子形成氢氧化物沉淀的pH,pH的取值范围为3.2![]() pH
pH![]() 7.15(使Fe3+完全沉淀,Co2+不形成沉淀)。加入NaF使浸出液中的Li+转化为LiF沉淀,滤渣B的主要成分为LiF、Fe(OH)3。
7.15(使Fe3+完全沉淀,Co2+不形成沉淀)。加入NaF使浸出液中的Li+转化为LiF沉淀,滤渣B的主要成分为LiF、Fe(OH)3。
(4)检验Fe3+用KSCN溶液,检验滤液B中是否还有残留的Fe3+的方法:取少量滤液B于试管中,向其中滴加KSCN溶液,观察溶液是否变红,若变红,则有Fe3+,反之则无Fe3+。
(5)n(CoC2O4·2H2O)=3.66g![]() 183g/mol=0.02mol,其中n(CoC2O4)=0.02mol,m(Co2C2O4)=0.02mol
183g/mol=0.02mol,其中n(CoC2O4)=0.02mol,m(Co2C2O4)=0.02mol![]() 147g/mol=2.94g。150℃~210℃固体质量为2.94g,此时固体为CoC2O4;290℃~320℃时固体质量为1.50g,根据Co守恒,其中n(Co)=0.02mol,n(O)=(1.50g-0.02mol
147g/mol=2.94g。150℃~210℃固体质量为2.94g,此时固体为CoC2O4;290℃~320℃时固体质量为1.50g,根据Co守恒,其中n(Co)=0.02mol,n(O)=(1.50g-0.02mol![]() 59g/mol)
59g/mol)![]() 16g/mol=0.02mol,n(Co):n(O)=0.02mol:0.02mol =1:1,290℃~320℃时固体为CoO,210℃~290℃时反应生成两种气体,则反应的方程式为CoC2O4
16g/mol=0.02mol,n(Co):n(O)=0.02mol:0.02mol =1:1,290℃~320℃时固体为CoO,210℃~290℃时反应生成两种气体,则反应的方程式为CoC2O4![]() CoO+CO↑+CO2↑。400℃~500℃时固体中n(Co)=0.02mol,固体中n(O)=(1.607g-0.02mol
CoO+CO↑+CO2↑。400℃~500℃时固体中n(Co)=0.02mol,固体中n(O)=(1.607g-0.02mol![]() 59g/mol)
59g/mol)![]() 16g/mol=0.0267mol,n(Co):n(O)=0.02mol:0.0267mol=3:4,400℃~500℃所得固体的化学式为Co3O4。
16g/mol=0.0267mol,n(Co):n(O)=0.02mol:0.0267mol=3:4,400℃~500℃所得固体的化学式为Co3O4。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】将一定质量的铜片加入到20 mL某浓度的浓硝酸中,充分反应后,铜片全部溶解,并收集到标准状况下的混合气体共896mL(假设[体中只有NO和NO2)。向反应后所得溶液中逐滴滴加lmol/L的NaOH溶液,产生沉淀质量与加入NaOH溶液体积(单位: mL)的关系如图所示。回答下列问题:
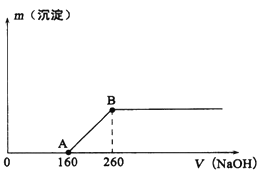
(1)B点所表示溶液中只含一种溶质,该物质是______(填化学式)。
(2)收集的气体中,NO2的物质的量为_______mol。
(3)原浓硝酸的浓度为_______mol/L。
(4)欲使铜与硝酸产生的混合气体在氢氧化钠溶液中全部转化为硝酸钠,至少需要30%的双氧水______g(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应. 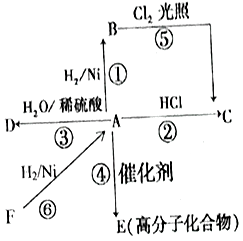
根据上图回答下列问题:
(1)写出A和D的结构简式:A , D .
(2)写出②⑤两步反应的化学方程式,其中②属于反应. ②;
⑤ .
(3)写出实验室中制取F的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“钿”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A. Ts是第七周期第VIIA族元素
B. Ts的同位素原子具有相同的电子数
C. 中子数为176的Ts核素符号是![]()
D. Ts在同族元素中非金属性最弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3: 物质结构与性质]
A、B、C、D为元素周期表中前四周期的四种元素,且原子序数依次增大,C、D同周期,且A、B、C均不在同一周期,其中A与D同主族,且该主族中有三种非金属元素,B为非金属元素且原子最外层有3对成对电子,C元素位于元素周期表第10列。请回答下列问题:
(1)C元素的原子序数为________,基态D原子的简化电子排布式为________。
(2)与A同一周期的所有主族元素中第一电离能小于A的元素共有_______种。
(3) D元素可形成DX3的卤化物,性质和结构与AX3类似(X表示卤素元素),在水溶液中强烈水解,请写出DCl3与水反应的化学方程式:____________。
(4) 如图为D2B3的分子结构图,B杂化方式为____________。

(5) 试比较A、B形成的简单氢化物的熔沸点的高低并解释:________ (简单氢化物用分子式表示)。
(6) 研究晶体结构的最常用方法是________;如图为一种含C和D两种元索的品体的晶胞图,呈六方结构,晶胞参数为底面边长为anm、高为bmm。
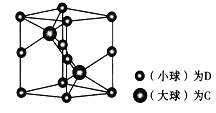
①该晶胞组成物质的化学式为__________。
②已知D和C的相对原子质量分别为M1和M2,若晶体密度为ρg/cm3,NA表示阿伏加德罗常数,用合理表达式表示该晶体的密度为________g/cm3 (列出计算式即可,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() (立方烷)的分子式均为C8H8,下列说法正确的是
(立方烷)的分子式均为C8H8,下列说法正确的是
A. Z的二氯代物有四种
B. X的同分异构体只有Y和Z
C. X、Y、Z中只有X 的所有原子可能处于同一平面
D. X、Y、 Z均可使溴的四氯化碳溶液因发生加成反应而褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
装置 | 分别进行的操作 | 现象 |
| i. 连好装置一段时间后,向烧杯中滴加酚酞 | |
ii. 连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液 | 铁片表面产生蓝色沉淀 |
(1)小组同学认为以上两种检验方法,均能证明铁发生了吸氧腐蚀。
①实验i中的现象是________________________________。
②用化学用语解释实验i中的现象:________________________________。
(2)查阅资料:K3[Fe(CN)6]具有氧化性。
①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是_____________________。
②进行下列实验,在实验几分钟后的记录如下:
实验 | 滴管 | 试管 | 现象 |
| 0.5 mol·L-1K3[Fe(CN)6]溶液 | iii. 蒸馏水 | 无明显变化 |
iv. 1.0 mol·L-1NaCl溶液 | 铁片表面产生大量蓝色沉淀 | ||
v. 0.5 mol·L-1 Na2SO4溶液 | 无明显变化 |
a. 以上实验表明:在条件下____________,K3[Fe(CN)6]溶液可以与铁片发生反应。
b. 为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明Cl-的作用是____________________。
(3)有同学认为上述实验仍不严谨。为进一步探究K3[Fe(CN)6]的氧化性对实验ii结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是___________(填字母序号)。
实验 | 试剂 | 现象 |
A | 酸洗后的铁片、K3[Fe(CN)6]溶液(已除O2) | 产生蓝色沉淀 |
B | 酸洗后的铁片、K3[Fe(CN)6]和NaCl混合溶液(未除O2) | 产生蓝色沉淀 |
C | 铁片、K3[Fe(CN)6]和NaCl混合溶液(已除O2) | 产生蓝色沉淀 |
D | 铁片、K3[Fe(CN)6]和盐酸混合溶液(已除O2) | 产生蓝色沉淀 |
(4)综合以上实验分析,利用实验ii中试剂能证实铁发生了电化学腐蚀的实验方案是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com