
【题目】过二硫酸铵![]() 是一种常用的氧化剂和漂白剂。某小组以辉铜矿(主要成分是
是一种常用的氧化剂和漂白剂。某小组以辉铜矿(主要成分是![]() )为原料用火法炼铜,并利用尾气制备过二硫酸铵。模拟工艺流程如下:
)为原料用火法炼铜,并利用尾气制备过二硫酸铵。模拟工艺流程如下:
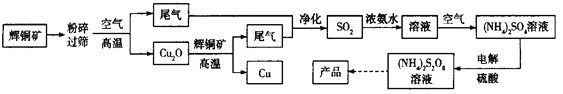
(1)矿石“粉碎过筛”的目的是_________。
(2)已知常温下![]() 的
的![]() ,
,![]() ,
,![]() 的
的![]() 。若浓氨水吸收
。若浓氨水吸收![]() 恰好生成
恰好生成![]() 溶液,则该溶液的pH__________(填“>”“<”或“=”)7。
溶液,则该溶液的pH__________(填“>”“<”或“=”)7。
(3)![]() 和
和![]() 按一定比例混合,在高温下反应的化学方程式为_______该反应中的氧化剂是_______(填化学式)。
按一定比例混合,在高温下反应的化学方程式为_______该反应中的氧化剂是_______(填化学式)。
(4)过二硫酸铵常用于检验废水中![]() 是否超标,若超标则溶液变为橙色(还原产物为
是否超标,若超标则溶液变为橙色(还原产物为![]() ),写出该反应的离子方程式:__________________。
),写出该反应的离子方程式:__________________。
(5)工业上,常采用钛基镀铂电极为阳极,铅锑合金为阴极,用质子交换膜将电解池分成两个室,将硫酸铵和硫酸分别加入到两个电极室进行电解制备过二硫酸铵,硫酸放入阴极室。写出阳极的电极反应式:___。
【答案】增大固体与气体的接触面积,加快反应速率 < ![]()
![]() 、
、![]()
![]()
![]()
【解析】
流程将粉碎的辉铜矿在空气中高温煅烧得氧化亚铜和二氧化硫,氧化亚铜和辉铜矿反应生成铜和二氧化硫,方程式为2Cu2O+Cu2S![]() 6Cu+SO2↑,将二氧化硫净化后用浓氨水吸收得到NH4HSO3,NH4HSO3在空气中被氧化为硫酸铵,将硫酸铵和硫酸分别加入到两个电极室进行电解制备过二硫酸铵,据此分析。
6Cu+SO2↑,将二氧化硫净化后用浓氨水吸收得到NH4HSO3,NH4HSO3在空气中被氧化为硫酸铵,将硫酸铵和硫酸分别加入到两个电极室进行电解制备过二硫酸铵,据此分析。
(1)粉碎矿石过筛,可以增大固体与气体的接触面积,加快固体与气体的反应速率;
答案:增大固体与气体的接触面积,加快反应速率
(2)![]() 的pKh=14-pKa1=12.19>pK a2,故其电离程度大于水解程度,又由于NH4+水解呈酸性,所以NH4HSO3溶液呈酸性;
的pKh=14-pKa1=12.19>pK a2,故其电离程度大于水解程度,又由于NH4+水解呈酸性,所以NH4HSO3溶液呈酸性;
答案:<
(3)氧化亚铜和辉铜矿反应生成铜和二氧化硫,方程式为2Cu2O+Cu2S![]() 6Cu+SO2↑,Cu2O、Cu2S中铜的化合价都降低,它们都是氧化剂;
6Cu+SO2↑,Cu2O、Cu2S中铜的化合价都降低,它们都是氧化剂;
答案:Cu2O、Cu2S
(4)由题意,反应物为Cr3+、S2O82-和H2O,生成物为Cr2O72-、SO42-和![]() 。根据得失电子守恒,电荷守恒和元素守恒书写离子方程式2Cr3++3 S2O82-+7H2O= Cr2O72-+6 SO42-+14H+;
。根据得失电子守恒,电荷守恒和元素守恒书写离子方程式2Cr3++3 S2O82-+7H2O= Cr2O72-+6 SO42-+14H+;
答案: 2Cr3++3 S2O82-+7H2O= Cr2O72-+6 SO42-+14H+
(5)阳极上硫酸根离子被氧化为S2O82-,电极反应式为2SO42—2e-= S2O82-;
答案:2SO42—2e-= S2O82-


科目:高中化学 来源: 题型:
【题目】对甲烷和CO2的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用,甲烷临氧耦合CO2重整反应有:
反应(i):2CH4(g)+O2(g)![]() 2CO(g)+4H2(g) △H=-71.4kJmol-1
2CO(g)+4H2(g) △H=-71.4kJmol-1
反应(ii):CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+247.0 kJmol-1
2CO(g)+2H2(g) △H=+247.0 kJmol-1
(1)写出表示CO燃烧热的热化学方程式:_______________________________。
(2)在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应(ii):CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) (不发生其它反应),CO2的平衡转化率如下表所示:
2CO(g)+2H2(g) (不发生其它反应),CO2的平衡转化率如下表所示:
容器 | 起始物质的量(n) / mol | CO2的 平衡转化率 | |||
CH4 | CO2 | CO | H2 | ||
Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
Ⅱ | 0.1 | 0.1 | 0.2 | 0.2 | / |
①下列能说明反应达到平衡状态是_________。
A.v正(CH4) =2v逆(CO)
B.容器内各物质的浓度满足c(CH4)·c(CO2)=c2(CO)·c2(H2)
C.容器内混合气体的总压强不再变化
D.容器内混合气体密度保持不变
②若容器Ⅰ内反应从开始到平衡所用的时间为t min,则t min内该反应的平均反应速率为:v(H2) = ________(用含t的表达式表示)。
③达到平衡时,容器Ⅰ、Ⅱ内CO的物质的量的关系满足:2n(CO)Ⅰ_______n(CO)Ⅱ(填“>”、“=”或“<”)
(3)将CH4(g)和O2(g)以物质的量比为4:3充入盛有催化剂的恒容密闭容器内,发生上述反应(i):2CH4(g)+O2(g)![]() 2CO(g)+4H2(g),相同时间段内测得CO的体积分数[ψ(CO)]与温度(T)的关系如图如示。
2CO(g)+4H2(g),相同时间段内测得CO的体积分数[ψ(CO)]与温度(T)的关系如图如示。
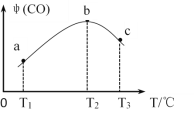
① T2℃时,CO体积分数最大的原因是_____________。
②若T2℃时,容器内起始压强为P0,平衡时CO的体积分数为20%,则反应的平衡常数KP =_______(用平衡分压强代替平衡浓度计算,分压=总压×物质的量分数)。
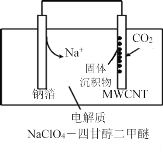
(4)2016年我国科研人员根据反应Na+CO2→ Na2CO3+C(未配平) 研制出一种室温“可呼吸”Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。其放电时的工作原理如图所示,已知吸收的全部CO2中,有![]() 转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面,写出放电时正极的电极反应式:_________________。
转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面,写出放电时正极的电极反应式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前一个分散系中慢慢地滴入后一种分散系所观察到的现象不是先沉淀后变澄清的是( )
A.氢氧化铁胶体中滴加盐酸
B.四羟基合铝酸钠溶液中加盐酸
C.氯化铝溶液中滴加烧碱溶液
D.氯化铝溶液中滴加氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、解释或结论均正确的是
选项 | 实验目的 | 操作 | 结论或解释 |
A | 检验 | 取待测液少许,加入过量的 | 液体分层,加入硝酸酸化的 |
B | 检验某溶液中有无 | 取待测液少许,加入盐酸,有气体放出,将气体通入澄清石灰水中 | 澄清石灰水变浑浊,则含 |
C | 检验溶液中的 | 取待测液少许,先通入氯气,再加KSCN溶液 | 溶液变红色,则含 |
D | 检验食盐中是否含 | 取少量食盐溶于水,加少量淀粉 | 溶液变蓝色,则含 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由两种或两种以上金属离子(或铵根离子)和一种酸根离子构成的盐称为复盐。为确定某复盐结晶水合物Q(含有两种金属阳离子)的组成,甲、乙两位同学分别进行了如下实验:
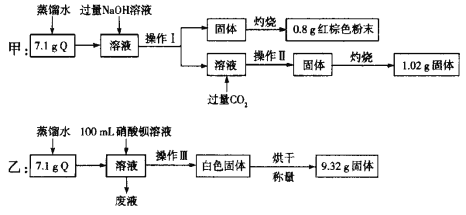
请回答下列问题:
(1)操作Ⅰ、Ⅱ、Ⅲ相同,为__________、洗涤,仅由甲的实验能不能确定操作Ⅰ中所得固体的成分?__________(填“能”或“不能”),说明理由:_________。
(2)甲实验中通入过量二氧化碳发生反应生成沉淀的离子方程式为_______。
(3)0.8 g红棕色粉末的物质的量为__________。
(4)乙实验中,若100 mL硝酸钡溶液恰好完全反应,则硝酸钡溶液的物质的量浓度为__________。
(5)Q的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤的烟气中含有 SO2,为了治理雾霾天气,工厂采用多种方法实现烟气脱硫。
Ⅰ.(1)“湿式吸收法”利用吸收剂与 SO2 发生反应从而脱硫。下列试剂中适合用作该法吸收剂的是_____(填字母序号)。
a. 石灰乳 b.CaCl2溶液
(2)某工厂利用含 SO2 的烟气处理含Cr2O72-的酸性废水,吸收塔中反应后的铬元素以Cr3+形式存在,具体流程如下:

①用 SO2 处理含铬废水时,利用了 SO2 的_____性。
②吸收塔中发生反应的离子方程式为_____。
Ⅱ.石灰-石膏法和烧碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为Ca(OH)2+SO2= CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O =2CaSO4·2H2O。其流程如图:

烧碱法的吸收反应为2NaOH+SO2=Na2SO3+H2O。该法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如图:

已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收 SO2 的成本(元/mol) | 0.027 | 0.232 |
(3)石灰-石膏法和烧碱法相比,石灰-石膏法的优点是_______,缺点是_______。
(4)某学习小组在石灰-石膏法和烧碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案,流程图中的甲、乙、丙各是_____、_____、_____(填化学式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙烷可作为全身麻醉剂,环已烷是重要的有机溶剂,下面是部分环烷烃及烷烃衍生物的 结构简式、键线式和某些有机化合物的反应式(其中 Pt、Ni 是催化剂)。



回答下列问题:
(1)环烷烃与____________是同分异构体。
(2)从反应①~③可以看出,最容易发生开环加成反应的环烷烃是____________(填名称)。判断依 据为____________。
(3)环烷烃还可以与卤素单质,卤化氢发生类似的开环加成反应,如环丁烷与 HBr 在一定条件下反 应,其化学方程式为____________(不需注明反应条件)。
(4)写出鉴别环丙烷和丙烯的一种方法.试剂____________;现象与结论____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃在碱性醇溶液中能发生消去反应。
例如,![]()
该反应式也可表示为
下面是几种有机化合物的转化关系:

(1)根据系统命名法,化合物A的名称是_____________。
(2)反应①的反应类型_________,反应③的反应类型___________
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:_______。
(4)C2的结构简式是______________,F1的结构简式是______________,F1与F2互为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的 SO2气体和 SO3气体相比较,正确的说法是
A. 密度比为 4:5 B. 物质的量之比为 4:5
C. 体积比为 1:1 D. 原子数之比为 3:4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com